

























 政策法规
政策法规

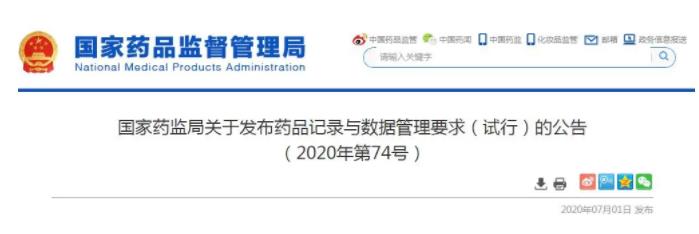
今天(7月1日),NMPA官网发布了《药品记录与数据管理(lǐ)要求(试行)》。该文(wén)件共有(yǒu)6大章节,涵盖30项具體(tǐ)细则,将于2020年12月1日正式实施。
2020-07-02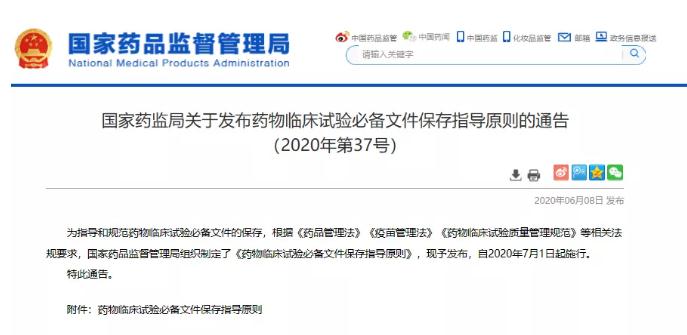
今天(6月8日),國(guó)家药监局官网发布了《药物(wù)临床试验必备文(wén)件保存指导原则》。该文(wén)件将于2020年7月1日起正式实行。 值得一提的是,國(guó)家药监局曾发文(wén)称新(xīn)版《药品注册管理(lǐ)办法》《药品生产监督管理(lǐ)办法》《药物(wù)临床试验质量管理(lǐ)规范》均将于今年7月起正式实施。如今加之《药物(wù)临床试验必备文(wén)件保存指导原则》,今年7月至少将有(yǒu)4项药类相关文(wén)件落地执行。
2020-06-08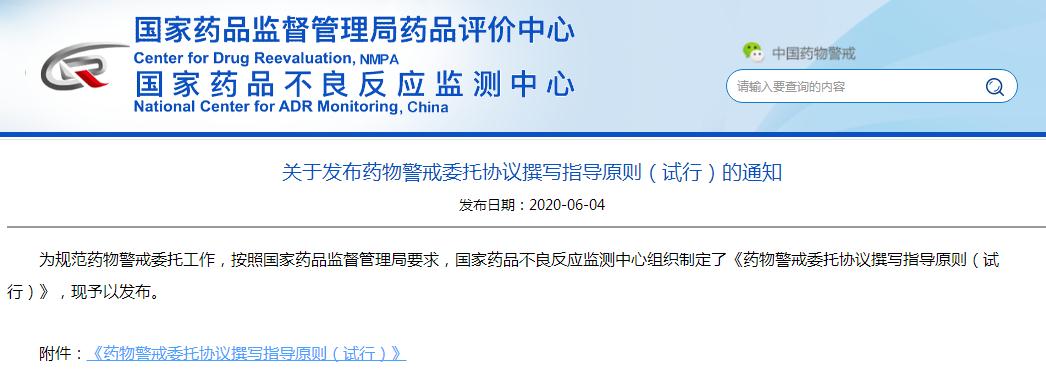
今天下午(6月4日),國(guó)家药品不良反应监测中心官网发布了《药物(wù)警戒委托协议撰写指导原则(试行)》。该文(wén)件共有(yǒu)4大章节,涵盖14项具體(tǐ)细则。
2020-06-04
今天(5月22日),CDE官网发布了《单臂试验支持注册的抗肿瘤创新(xīn)药进入关键试验前临床方面沟通交流技术指导原则(征求意见稿)》。该《征求意见稿》共分(fēn)為(wèi)四大章节,征求意见时限為(wèi)1个月。
2020-05-22
