

































药物(wù)临床研究指在人體(tǐ)(病人或健康志(zhì)愿者)进行药物(wù)的系统性研究,以证实或揭示试验药物(wù)的作用(yòng)、不良反应及/或试验药物(wù)的吸收、分(fēn)布、代謝(xiè)和排泄规律,目的是确定试验药物(wù)的疗效与安全性,主要包括Ⅰ-Ⅳ期临床研究。根据我國(guó)新(xīn)药注册的法律法规,药物(wù)临床研究须由具备临床试验机构资格的医疗机构进行。公司的临床研究服務(wù)主要是接受申办者委托,与申办者、主要研究者共同制定临床研究方案、监查临床研究过程、进行临床试验的数据管理(lǐ)、统计分(fēn)析并协助完成临床研究总结报告等。同时,公司还对外单独承接数据管理(lǐ)、统计分(fēn)析和代理(lǐ)注册等与新(xīn)药研发有(yǒu)关的其他(tā)咨询服務(wù)。
在临床研究服務(wù)领域,累计為(wèi)500多(duō)家客户提供临床前研究服務(wù)400多(duō)项和临床研究服務(wù)800多(duō)项,基本涵盖了药物(wù)治疗的各个专业领域,并包括难度较高的创新(xīn)药60多(duō)项,通过公司提供的临床研究服務(wù)助力客户获得新(xīn)药证书60多(duō)项,生产批件约80多(duō)项,完成的临床研究服務(wù)项目涵盖了心血管、呼吸、消化、内分(fēn)泌、泌尿、肿瘤、神经内科(kē)、妇科(kē)、皮肤科(kē)、耳鼻喉科(kē)、眼科(kē)、儿科(kē)、外科(kē)、麻醉科(kē)等多(duō)个药物(wù)治疗的专业领域。

我们的优势:
1、敏锐的政策洞察力---与NMPA(原CFDA)、发改委、卫健委、人保部等相关部门有(yǒu)畅通的咨询和沟通渠道;视角敏锐,在评价设计与实施中可(kě)密切结合未来政策导向,满足政策需求;熟悉研发、医保、基药、定价等最新(xīn)政策变化。
2、全方位的专家团队---涵盖医學(xué)、药學(xué)、流行病學(xué)、统计學(xué)、药物(wù)经济學(xué)、市场营销、企业管理(lǐ)、法學(xué)、公共管理(lǐ)各专业领域的顶级人才团队,可(kě)从企业战略、市场营销、产品線(xiàn)规划、产品临床定位等多(duō)个角度全面考虑,进而制定最符合企业战略的整體(tǐ)计划。
3、丰富的专家资源---与國(guó)内各治疗领域意见领袖、权威學(xué)术机构有(yǒu)着广泛合作,如中华医學(xué)会、中國(guó)药學(xué)会、中华中医药學(xué)会、中國(guó)中药协会、高等院校、药政管理(lǐ)部门等顶尖的临床专家;可(kě)组织國(guó)内权威专家共同定制临床方案,完成后并在國(guó)外有(yǒu)影响的學(xué)术期刊发布论文(wén),以扩大國(guó)内的學(xué)术影响,提升品牌形象并推动销售。
4、广泛的合作医院网络---分(fēn)布全國(guó)各省、市的超过800家合作医院
6、分(fēn)布完善的办事机构网络--广州总部、北京子公司、上海子公司和全國(guó)25个省会城市
7、庞大的受试者数据库和完善的受试者招募體(tǐ)系
8、先进的数据管理(lǐ)软件---EDC電(diàn)子病例采集系统
9、丰富的创新(xīn)药项目经验(60余项),特别是抗感染、肝病、消化、肿瘤、风湿免疫、骨科(kē)领域,已积累了丰富的项目运营管理(lǐ)经验。
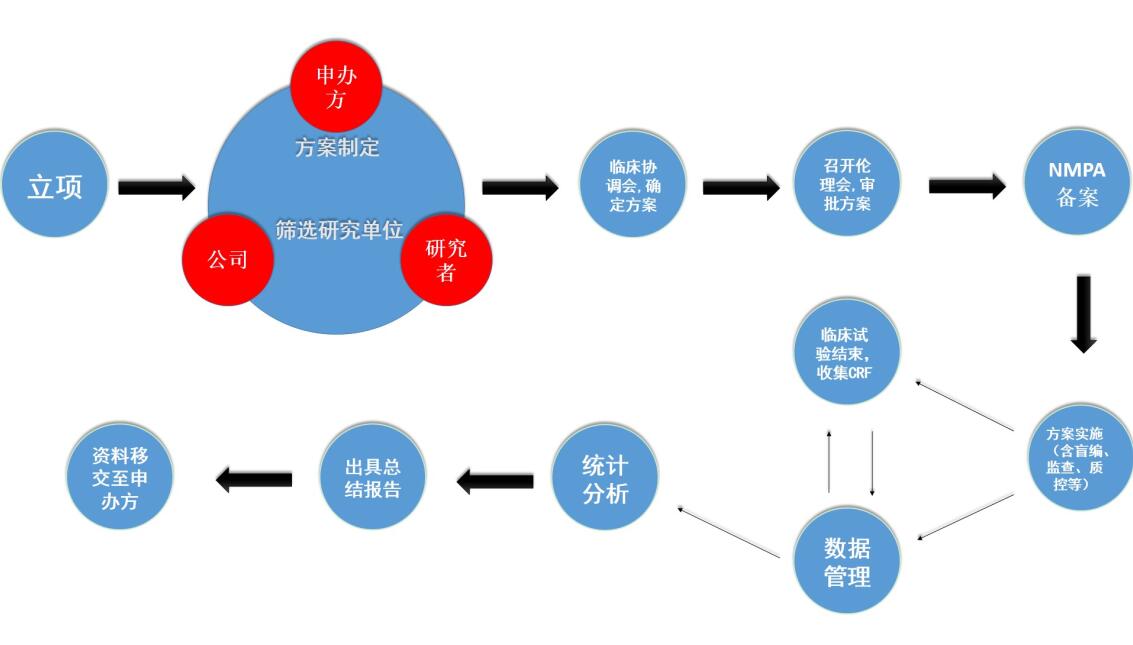
临床研究服務(wù)的主要流程如下:
(1)立项
项目成功与申办方签订合作协议后,由商(shāng)務(wù)人员对公司临床部、医學(xué)部、数据管理(lǐ)统计分(fēn)析同时进行立项,并组织召开会议,明确项目范围和申办方的需求。
(2)制定方案初稿及筛选研究单位
公司临床部负责选择临床研究单位(对每个研究单位进行详细的调研和评估),其中一家研究单位作為(wèi)组長(cháng)单位(个别申办方会建议某家研究单位作為(wèi)组長(cháng)单位),同时联系确定参加单位。医學(xué)部负责研究方案初稿的拟定,统计人员进行方案中有(yǒu)关统计學(xué)内容的撰写。
(3)召开临床研究协调会
公司、申办者与所有(yǒu)研究单位一起召开临床研究协调会,讨论并确定临床研究方案。
(4)伦理(lǐ)委员会审批,备案
确定临床研究方案后,报组長(cháng)单位伦理(lǐ)委员会审批。组長(cháng)单位召开伦理(lǐ)委员会审批临床研究方案等资料,取得组長(cháng)单位的伦理(lǐ)委员会批件后,将研究方案等资料提交申办者向國(guó)家药监局及相关省药监局进行备案登记。如果组長(cháng)单位伦理(lǐ)委员会审核时对方案等资料提出修改意见的,则需在方案等资料修改后再次召开伦理(lǐ)委员会审批同意才能(néng)实施。除组長(cháng)单位外,其他(tā)参加单位会视情况召开分(fēn)中心伦理(lǐ)审查会议对研究方案等资料进行审批。如果参加单位对临床试验方案等资料提出异议,则需反馈至组長(cháng)单位及申办方再次对方案进行讨论和修改。如果参加单位对最终确定的临床研究方案等资料还有(yǒu)异议,则可(kě)以选择退出该项目的临床研究。临床方案确定后,还需要将组長(cháng)单位的伦理(lǐ)委员会批件、临床研究方案、药检报告等研究资料在所有(yǒu)参加单位备案。
在获得伦理(lǐ)委员会批件后,由非参与统计分(fēn)析的统计专业工作人员对申办方提供的临床试验用(yòng)药物(wù)进行随机编盲工作。
涉及外资背景的申办方,需要在伦理(lǐ)获得批准后,申请遗传办备案,获批准后才能(néng)开展试验。
(5)临床试验开始、进行、结束
临床研究开始前,临床部与所有(yǒu)临床研究单位签订临床研究协议。临床研究协议签署后,通知申办方将临床试验用(yòng)药物(wù)送达相应研究单位。负责该项目的项目经理(lǐ)和监查员对相关研究者进行临床研究方案的培训,试验正式开始。在临床研究期间,监查员严格按照相关规定,检查入组病例是否符合方案规定的入选要求、排除标准,研究资料是否准确、及时、真实的填写,检查核对实验室数据并出具监查报告。病人出组后,监查员检查核对所有(yǒu)研究中心的病例资料,并回收研究资料和剩余临床试验用(yòng)药物(wù),清点剩余临床试验用(yòng)药物(wù)返还申办方。
(6)数据管理(lǐ)和统计分(fēn)析
回收临床研究资料后,数据管理(lǐ)员制定数据管理(lǐ)计划,根据临床试验方案编写数据核查计划,对数据进行检查,出具疑问表提交至研究者进行答(dá)疑,根据研究者答(dá)疑表对数据库进行修正。答(dá)疑结束后,召开数据审核会,会后锁定数据库(盲法试验时需进行揭盲)。统计人员根据锁定的数据库,按照统计分(fēn)析计划进行统计分(fēn)析,出具统计分(fēn)析报告。
(7)总结会、总结报告
统计分(fēn)析报告完成后,公司各业務(wù)部门(包括医學(xué)部、临床部、统计分(fēn)析人员等)与研究单位召开临床研究总结会,对统计分(fēn)析报告进行讨论和定稿,并对临床研究进行总结。由医學(xué)部根据统计分(fēn)析报告拟定总结报告及各分(fēn)中心的小(xiǎo)结报告初稿,并再次送交各研究单位进行审核定稿、签字确认,将研究者签字确认的总结报告提交各药物(wù)临床试验机构签章。临床研究总结报告、小(xiǎo)结报告等研究资料是申办者申请新(xīn)药证书和药品注册批件的重要资料。
(8)质控,资料移交
项目全过程均受质量管理(lǐ)与控制,项目开展前期在质量控制部支持下明确项目的质量管理(lǐ)要求,过程中安排定期对试验文(wén)件进行系统检查;申报资料在提交有(yǒu)关部门前,将经过质量控制部安排全面核定以保证其质量。试验完成后,最终通过质控的资料将被统一移交至申办者并签署交接清单。
公司成立以来,已為(wèi)近四百家客户提供药學(xué)研究、药物(wù)學(xué)研究、毒理(lǐ)學(xué)研究等技术服務(wù)。

出于对合作伙伴的信息保密,本公司只选择性的公布部分(fēn)已完成项目:
1.用(yòng)于新(xīn)型冠状病毒肺炎患者的医疗器械,氢氧气雾化机(钟南山(shān)院士牵头);
2.化药1类新(xīn)药,治疗ED,TPN729;
3.化药1类新(xīn)药,治疗乙型肝炎;
4.化药1类新(xīn)药,治疗非小(xiǎo)细胞肺癌,HEmay020胶囊;
5.化药1.1类新(xīn)药,YPS345片,治疗呼吸系统疾病;
6.生物(wù)制品1类,“EPO融合蛋白”,治疗肾性贫血;
7.生物(wù)制品1类,SK08,治疗肠易激综合症;
8.化药1类新(xīn)药,盐酸椒苯酮胺,治疗急性心衰;
9.化药1类新(xīn)药,枸橼酸雄地那非片,治疗ED;
10.化药1类新(xīn)药MRX-I片,治疗皮肤感染;
11.化药1类新(xīn)药,左旋盐酸苯环壬酯片(晕动病);
12.中药1类新(xīn)药,注射用(yòng)银杏内酯B,治疗急性缺血性脑卒中;
13.PreIND申请,创新(xīn)药“765IGF-MTX”國(guó)际多(duō)中心临床(骨质增生异常综合症);
14.PreIND申请,化药1类新(xīn)药,喷雾用(yòng)YJ001,治疗糖尿病周围神经痛(浙江);
15.PreIND申请,化药1类新(xīn)药,干扰素(孤儿药);
16.PreIND申请,生物(wù)制品1类SI-006;
17.进口注册,治疗前列腺癌、黑色素瘤、胰腺癌,甲磺酸马赛替尼片临床研究;
18.三类植入人工心脏,治疗难治性终末期心衰;
19.三类植入左心耳封堵器系统用(yòng)于非瓣膜性心房颤动(葛均波院士牵头);
......

