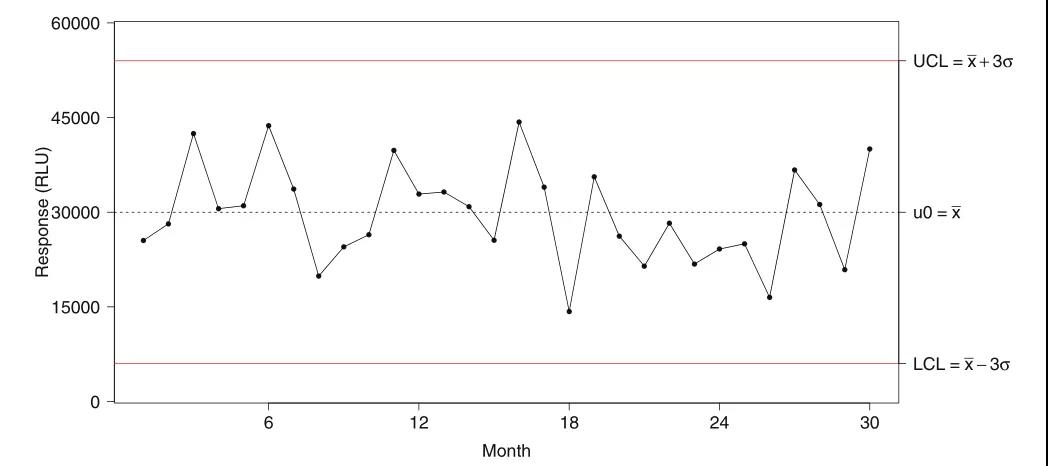
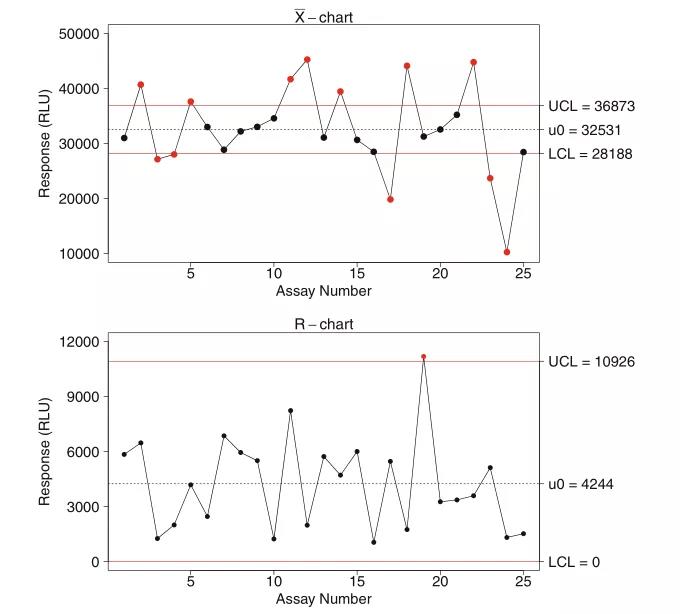
上周,“袁来如此”专栏初步介绍了LBA中的质量控制样品(QC,quality control)制备、认证(qualification)和批次一致性维护的相关概念和实践方法(袁来如此|大分(fēn)子生物(wù)分(fēn)析概论(八_上):LBA方法质量控制样品的制备和认证)。本期将延续上期内容,重点就监管机构对QC的要求、跟踪QC的效能(néng)趋势、防止分(fēn)析漂移等方面做了详细解读。
“袁来如此”专栏系广州博济医药微信公众号打造的科(kē)普學(xué)术专栏,内容均為(wèi)博济医药子公司深圳博瑞副总经理(lǐ)袁智博士原创。
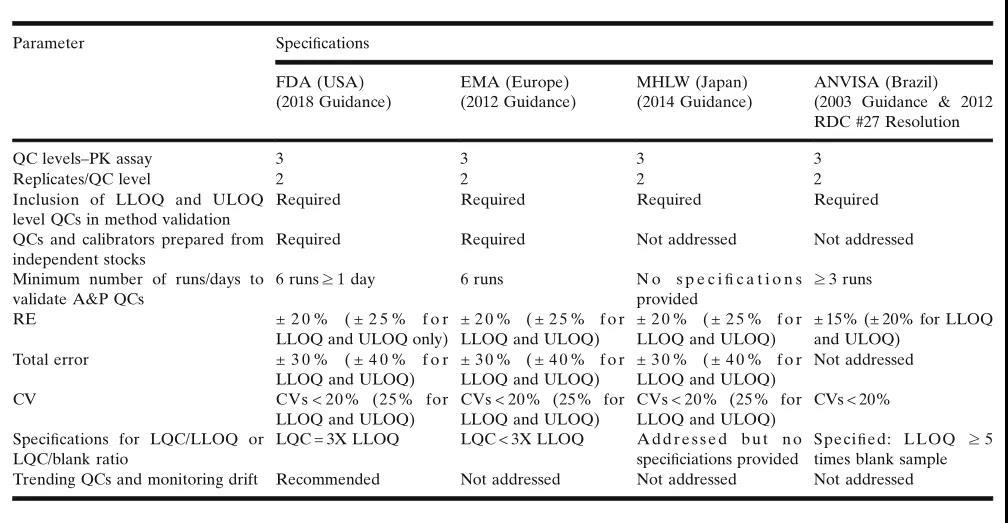
表3.监管机构对用(yòng)于定量分(fēn)析QC的要求之比较。