

























本期《袁来如此》為(wèi)系列文(wén)章《大分(fēn)子生物(wù)分(fēn)析概论》的第七篇,将重点就已发表的文(wén)献资料对抗體(tǐ)的总浓度和游离浓度的定量分(fēn)析及其在药代动力學(xué)中的应用(yòng)进行初步的介绍。
由于内容篇幅较長(cháng),本文(wén)将采取上下篇形式进行推送,敬请垂注!《袁来如此》专栏系广州博济医药微信公众号打造的科(kē)普學(xué)术专栏,内容均為(wèi)博济医药子公司深圳博瑞副总经理(lǐ)袁智博士原创。
支持用(yòng)于药物(wù)开发的生物(wù)分(fēn)析的主要驱动力是数据的预期应用(yòng)。配體(tǐ)结合式测试方法(LBA)被广泛用(yòng)于蛋白质生物(wù)药和靶标配體(tǐ)(target ligands,L)的分(fēn)析,以支持药代动力學(xué)/药效學(xué)(PK/PD)和安全性评估。特别是对于以非共价键结合其靶标配體(tǐ)的单克隆抗體(tǐ)药物(wù)(mAb),體(tǐ)内可(kě)以存在多(duō)种形式的mAb与其靶标配體(tǐ),包括游离的mAb,游离的L以及mAb和L的一价和/或二价复合物(wù)(mono- and/or bivalent complexes of mAb and L)。
考虑到给药后體(tǐ)内发生的动态结合平衡的复杂性以及在生物(wù)分(fēn)析过程中该平衡受到多(duō)种来源的扰动,对待测物(wù)的不同形态(游离、结合或总體(tǐ)mAb和L)以间接體(tǐ)内形式(ex vivo)进行定量分(fēn)析得出的结果,可(kě)能(néng)与體(tǐ)内(in vivo)的实际情况不同。原则上,可(kě)以设计LBA试剂和测试格式,用(yòng)于测定mAb和L的总浓度或游离浓度。
本文(wén)主要关注mAb生物(wù)药与血液循环中以可(kě)溶形式分(fēn)泌出来的,或从膜受體(tǐ)上脱落的靶标配體(tǐ)和L。本文(wén)从理(lǐ)论和实践上研究了如何测定的总體(tǐ)/游离的待测物(wù)浓度,以提升科(kē)學(xué)界的相关认知,并提供了相关生物(wù)分(fēn)析策略,以便在药物(wù)开发的特定阶段提供所需的PK/PD的信息。
基于靶向药理(lǐ)机制的生物(wù)药已经成為(wèi)了当前颇具前景的药物(wù)开发方式。生物(wù)药主要由单克隆抗體(tǐ)(mAb)药物(wù)组成,很(hěn)多(duō)个mAb已经FDA批准作為(wèi)药物(wù)上市使用(yòng),预计未来将有(yǒu)更多(duō)相关药物(wù)获得进入市场。
定量测定血液循环中的mAb及其靶标配體(tǐ)(L)的可(kě)靠分(fēn)析方法对于评估mAb的暴露量-响应关系、支持其有(yǒu)效性和安全性评价、治疗剂量的选择是至关重要的。配體(tǐ)结合测定法(LBA)通常用(yòng)于定量分(fēn)析mAb及其相关L的浓度,在生物(wù)體(tǐ)内环境中存在多(duō)种形式的mAb和L,包括游离mAb、游离L和 mAb和L的一价和/或二价复合物(wù)。当L是二聚體(tǐ)或多(duō)聚體(tǐ)时,则会产生额外的复杂性,可(kě)以设计LBA试剂和分(fēn)析格式来进行测量,包括mAb及其L的结合及游离形态。这其中,确定LBA方法所测量的确切形态至关重要。
由于LBA的数据是用(yòng)于评估药代动力學(xué)/药效學(xué)(PK/PD)关系,因此,為(wèi)了适当评估PK/PD,使用(yòng)相关的分(fēn)析方法清楚地阐明mAb和L的相互作用(yòng)是非常重要的。本文(wén)描述如下相关共识
同时,本文(wén)為(wèi)选择mAb和L的总體(tǐ)和游离浓度的测定方法提供了一个实用(yòng)的策略,将从以下方面阐述:
生物(wù)體(tǐ)液中游离、部分(fēn)游离(partially free,也称為(wèi)部分(fēn)结合/ partially bound),结合(bound)全部(total)mAb和L的术语。对于mAb,将其“游离/free”部分(fēn)实用(yòng)性地定义為(wèi)表现出与其未结合形式(unbound forms)相等同的生物(wù)活性的形式。由于mAbs的二价性,游离mAb既包括未结合(unbound)mAb,也包括部分(fēn)结合mAbs(即一价结合的/monovalently bound),这些形式通常是使用(yòng)未结合的参考标准物(wù)(unbound reference standards)来定量的。总體(tǐ)mAb将是完全结合形式(fully bound)、部分(fēn)结合形式(partially bound)和非结合形式(unbound)的总和。
除了与mAb结合外,L还可(kě)以与其它蛋白质结合,并且L上可(kě)能(néng)有(yǒu)多(duō)个结合位点,具有(yǒu)或不具有(yǒu)协同效应。為(wèi)了简化讨论,本文(wén)将不讨论L的多(duō)价结合(multivalent binding)和与近端蛋白(proximal protein)结合。在此,本文(wén)简化了靶标配體(tǐ),L,的定量,只包括“游离”(非结合,Lfree)和总體(tǐ)(包括与mAb结合和非结合的形式,Ltotal);相应的参考标准物(wù)由特定的方法来确定。
虽然本文(wén)提供了一些文(wén)献中的案例研究和例子,但目的不是要包罗万象。為(wèi)了避免文(wén)章冗長(cháng),不会详细讨论表1中的例子,只作為(wèi)参考文(wén)献列出。有(yǒu)兴趣的读者可(kě)参阅相关文(wén)献。
生物(wù)分(fēn)析战略的主要驱动力是使用(yòng)这些数据為(wèi)药物(wù)开发进行决策参考。取决于决策所需要的信息,在药物(wù)开发的不同阶段所需的数据以及因此所选择的定量方法(游离,全部,或两者都要)可(kě)能(néng)不同。
在药物(wù)开发的早期阶段,特定的试剂可(kě)能(néng)无法用(yòng)于开发游离的mAb或L的分(fēn)析方法。因此,生物(wù)分(fēn)析科(kē)學(xué)家和数据使用(yòng)者应了解并就下列问题进行交流:
(1)生物(wù)分(fēn)析数据的预期用(yòng)途;
(2)血液循环中mAb和L之间的动态平衡关系;
(3)分(fēn)析方法的技术性挑战(technical challenges)及其实际局限性(practical limitations)。

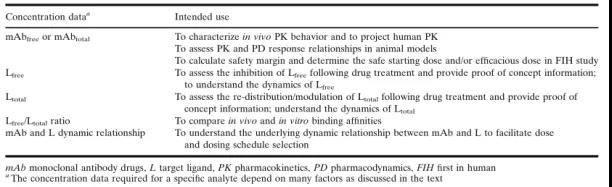
在临床前开发阶段, 血清mAb的浓度用(yòng)于建立非临床物(wù)种中的PK行為(wèi),并预测首次人體(tǐ)给药(FIH)时的起始剂量 (表2)。靶标配體(tǐ)L的浓度用(yòng)于评估mAb与L的动态平衡关系,以帮助确定具有(yǒu)生物(wù)活性的mAb浓度,并用(yòng)于PK建模,从而确定给药剂量和方案。
临床阶段的数据则用(yòng)于描述人體(tǐ)药代动力學(xué)特征,定义PK/PD与安全性和有(yǒu)效性的关系,并在目标患者人群中建立PK/PD模型,以支持药物(wù)的批准上市和使用(yòng)以及药品标签。详细的PK/PD数据的应用(yòng)列于表2和表3。
在许多(duō)情况下,生物(wù)药的药理(lǐ)效应是由游离的mAb和mAbfree所决定的。如果mAb与可(kě)溶性配體(tǐ)结合,以防止其与同源受體(tǐ)结合(或通过其传递信号)。如果能(néng)够在游离靶标配體(tǐ)与Lfree的结合与临床响应之间建立起相关性,与L的结合和捕获就可(kě)以作為(wèi)PK/PD建模和给药方案选择时一个直接的生物(wù)标志(zhì)物(wù)。虽然 mAbfree反映了mAb在體(tǐ)内的游离状态和结合能(néng)力,但评估mAbtotal可(kě)以进一步帮助描述mAb与L之间的动态相互作用(yòng)。mAb/L的比值与其动态平衡(dynamic equilibrium)高度影响生物(wù)分(fēn)析方法的特异性。因此,了解药物(wù)开发不同阶段所需的信息是十分(fēn)重要。

药代动力學(xué)家通常对mAbfree颇為(wèi)敏感,因為(wèi)mAbfree的水平反映了可(kě)利用(yòng)的活性药物(wù)。当然,毒理(lǐ)學(xué)家也对mAbtotal非常敏感,因為(wèi)mAb的靶向或脱靶效应(on- or off-target effects)可(kě)能(néng)带来安全隐患。因此,在使用(yòng)这些数据之前,药代动力學(xué)家和毒理(lǐ)學(xué)家必须了解具體(tǐ)的生物(wù)分(fēn)析方法是什么,并决定是否需要进行额外的分(fēn)析。
就此而言,如果在药物(wù)开发的后期改变了定量分(fēn)析方法,那么可(kě)能(néng)需要重新(xīn)评估PK或PD模型,因為(wèi)这些模型是基于特定的定量分(fēn)析方法产生药物(wù)浓度-时间行為(wèi)。从游离或结合的mAb的分(fēn)析方法的角度,有(yǒu)综述分(fēn)析了21个FDA已批准上市的mAb药物(wù)的LBA方法。这些报告大多(duō)没有(yǒu)具體(tǐ)说明分(fēn)析方法的格式,因此不同分(fēn)析方法产生的PK参数可(kě)能(néng)不一致。
由此来看,在制定mAb的生物(wù)分(fēn)析策略时,重要的是与不同功能(néng)团队中的关键利益攸关方合作。包括药物(wù)开发项目所处的阶段,何时以及如何测定每个药物(wù)开发项目中的mAb和L。
质量作用(yòng)定律支配着mAb和L的结合。
该定律首先是由Guldberg和Waage于1864年提出,并被广泛用(yòng)于描述可(kě)逆性结合的相互作用(yòng)(reversible binding interactions):从steroid hormones与其结合蛋白,到mAb和L的可(kě)逆性结合。一般选择对靶标配體(tǐ)(L)的有(yǒu)高结合亲和力(binding affinity)的mAb作為(wèi)药物(wù)来开发,平衡解离常数(equilibrium dissociation constants,Kd)通常在几个nM到pM的浓度范围。结合动力學(xué)一般是非線(xiàn)性的、容量有(yǒu)限的(capacity limited),其结合符合二级动力學(xué)特征(second-order association)。
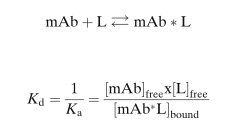
其中,Kd和Ka分(fēn)别為(wèi)平衡解离常数和结合常数。
质量作用(yòng)定律可(kě)用(yòng)于计算或预测平衡中各组分(fēn)的浓度。Le Chatelier原理(lǐ)也描述了平衡随浓度变化而移动的趋势。图1表明,mAb结合到L的部分(fēn)(fraction of mAb bound to L),除取决于Kd外,还取决于mAb和L的浓度比值。
图1. 在一定的mAb/L摩尔比范围内,mAb-L亲和力对 mAbfree的影响。将L的浓度固定為(wèi)常数,用(yòng)于模拟计算 mAbfree。為(wèi)了便于解释,本例中的摩尔比是基于假设每摩尔药物(wù)有(yǒu)一个结合位点;对于mAb,每摩尔药物(wù)有(yǒu)两个结合位点。
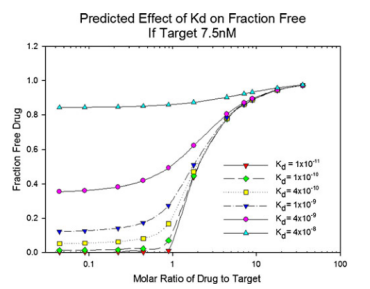
图1. 在一定的mAb/L摩尔比范围内,mAb-L亲和力对 mAbfree的影响。将L的浓度固定為(wèi)常数,用(yòng)于模拟计算 mAbfree。為(wèi)了便于解释,本例中的摩尔比是基于假设每摩尔药物(wù)有(yǒu)一个结合位点;对于mAb,每摩尔药物(wù)有(yǒu)两个结合位点。
在给药后,一般假定mAb与可(kě)溶性L的结合遵循质量作用(yòng)定律。因此,可(kě)以定量分(fēn)析血浆或血清样本中mAb和L的浓度,以阐明PK/PD关系的动态平衡。如在《药物(wù)和靶点生物(wù)分(fēn)析数据的应用(yòng)》章节中所讨论的,根据质量作用(yòng)定律的预测,mAb或L的體(tǐ)内平衡将以依赖于PK动力學(xué)和L的响应动力學(xué)的方式,向游离或结合状态移动,如表4所示的情况分(fēn)类。高比例的mAb/L的第一种情况是高剂量的mAb与L具有(yǒu)高结合亲和性,这是药物(wù)开发中经常遇到的情况。 但在某些情况下,L可(kě)能(néng)会累积并在某些时间点导致mAb/L比值降低。Lfree和/或Ltotal的增加可(kě)能(néng)在给药后伴随L的积累而发生,并可(kě)能(néng)抵消抑制L的预期效果,或可(kě)能(néng)带来其他(tā)安全问题。
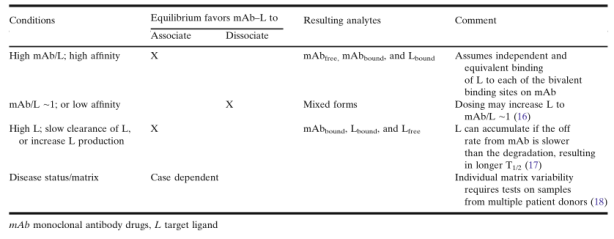
除了考虑给药后mAb-L结合的體(tǐ)内动力學(xué)外,离體(tǐ)状况(ex vivo conditions)如样品采集、储存、运输和样本分(fēn)析等可(kě)能(néng)使样本的平衡状态与體(tǐ)内(in vivo)状态大不相同。表5列出了一些可(kě)能(néng)影响结合或解离平衡动力學(xué)的状况。
在样品采集和分(fēn)析过程中,由于平衡可(kě)能(néng)受到扰动,不同mAb和/或L的相关形式(游离的、结合的、总L和mAb)的离體(tǐ)定量可(kě)能(néng)会偏离體(tǐ)内的实际值。此外,偏差的程度取决于研究过程中样本采集的时间,因此,很(hěn)难预测由这样的实验确定的PK/PD行為(wèi)与體(tǐ)内的真实状况的相似程度。

在含有(yǒu)这些不同形式的混合物(wù)的样本中,而且当很(hěn)难控制mAb和/或L的特定形式的平衡动力學(xué)时,将平衡驱动到主要以mAb和L的游离或结合(总體(tǐ))的形式存在,然后进行定量分(fēn)析的价值较大。此外,使用(yòng)分(fēn)离步骤来分(fēn)离游离的和结合的形式,并定量特定的形式,以获得药物(wù)开发的每个阶段所需的PK或PD信息。许多(duō)LBA检测平台和条件都足够灵活,可(kě)以完成这项工作。
本文(wén)后续将分(fēn)别在《抗體(tǐ)药物(wù)的定量生物(wù)分(fēn)析方法》和《靶标配體(tǐ)的生物(wù)分(fēn)析方法》章节中,讨论针对mAb和L的具體(tǐ)形式的多(duō)种定量方法。敬请垂注!


