

























上周,“袁来如此”专栏就药物(wù)开发过程中如何缓解或消除对LBA定量分(fēn)析方法干扰的策略展开了详细介绍(袁来如此|大分(fēn)子生物(wù)分(fēn)析概论(六)上:LBA定量抗體(tǐ)药物(wù)的背景干扰及其消除),本期将延续上期内容,重点关注抗體(tǐ)生物(wù)药的定量分(fēn)析。
“袁来如此”专栏系广州博济医药微信公众号打造的科(kē)普學(xué)术专栏,内容均為(wèi)博济医药子公司深圳博瑞副总经理(lǐ)袁智博士原创。
LBA测试方法常用(yòng)于定量生物(wù)基质中抗體(tǐ)药物(wù)的浓度,根据测试格式的不同,LBA可(kě)以测定游离药物(wù)的浓度或药物(wù)总量。游离药物(wù)是指不与靶点结合的治疗性抗體(tǐ)。药物(wù)总量则指游离的加上结合了靶标的药物(wù)。由于PK数据至关重要,相关监管指南和行业共识都对定量方法的验证提出了相关建议,包括应对干扰的一些方面。
游离的抗體(tǐ)药物(wù)的测定通常使用(yòng)抗原或中和性抗独特型抗體(tǐ)(anti-ID)作為(wèi)捕获抗體(tǐ)。检测抗體(tǐ)可(kě)以是中和性anti-ID、非中和性anti-ID、抗人IgG、抗人特定等型(specific isotype)抗體(tǐ)(如抗人IgG2特异性抗體(tǐ))或抗药物(wù)抗體(tǐ)的框架突变(anti-framework mutations)的抗體(tǐ)。抗體(tǐ)药物(wù)总量可(kě)被非中和性anti-ID、抗人IgG、抗人特定等型(specific isotype)抗體(tǐ)或抗药物(wù)抗體(tǐ)的框架突变的抗體(tǐ)捕获和检测。但是,很(hěn)少能(néng)得到非中和性anti-IDs,因為(wèi)在大多(duō)数情况下,生产anti-IDs时会产生很(hěn)多(duō)中和性anti-IDs,但非中和性anti-IDs的产生量却很(hěn)少。
游离抗體(tǐ)药物(wù)的定量在技术上是具有(yǒu)挑战性的,特别是当可(kě)溶性靶标在样本中处于高水平时,许多(duō)基质成分(fēn)可(kě)以显著改变可(kě)溶性靶标的水平或影响药物(wù)与可(kě)溶性靶标的结合,从而引起游离药物(wù)浓度的变化。此外,这些成分(fēn)也很(hěn)有(yǒu)可(kě)能(néng)对之前所讨论的可(kě)溶性靶标定量起到干扰。
在定量分(fēn)析抗體(tǐ)-药物(wù)偶联物(wù)(ADCs)时,样本的制备具有(yǒu)特殊意义,因為(wèi)ADCs可(kě)以在采集的样本中或體(tǐ)内发生生物(wù)转化,使本已复杂的ADC生物(wù)分(fēn)析更加复杂化。
即使是单克隆抗體(tǐ)的定量也会受到样本制备方法的影响。例如,使用(yòng)EDTA作為(wèi)抗凝剂会螯合阳离子(如Ca2+和Mg2+),从而影响游离抗體(tǐ)药物(wù)浓度的准确测定,如果这些阳离子是药物(wù)与靶标结合所必需的。
在样本收集和制备过程中,不理(lǐ)想的程序(如上半篇提到的生物(wù)标志(zhì)物(wù)部分(fēn)所讨论的)会从细胞中释放可(kě)溶性靶标,导致样本中靶标的浓度人為(wèi)地升高,从而低估了游离抗體(tǐ)的浓度。
為(wèi)了减少这些潜在的干扰,在对每个抗體(tǐ)药物(wù)进行分(fēn)析时,都应该优化样本采集程序和检测条件。正如前文(wén)所提到的,制备血清的过程可(kě)释放储存在血小(xiǎo)板中的蛋白质,而使用(yòng)血浆则可(kě)避免它的释放。此外,可(kě)以实施样本增稳的条件,如低温,可(kě)以减少在样本收集过程中蛋白质从细胞中释放出来的量。在检测试剂存在的情况下先进行样本酸解处理(lǐ),再进行中和处理(lǐ),或在检测过程中保持样本的弱酸性,该方法已被证明可(kě)以有(yǒu)效地减少来自靶标的干扰。
对于游离抗體(tǐ)药物(wù)的分(fēn)析,应该优化检测条件,如孵育时间、捕获试剂的浓度和最低稀释要求,以最大限度地减少药物(wù)从它的靶标解离。这对与其靶标亲和力较低、在血液循环中可(kě)溶性靶标浓度较高的抗體(tǐ)药物(wù),尤為(wèi)重要。因此,需要在研究人群中评估稀释線(xiàn)性度和样本稳定性,以将靶标水平的变化对游离药物(wù)定量的准确性这一影响纳入考虑。
当使用(yòng)抗原捕获待测物(wù)时,高浓度的结合蛋白或可(kě)溶性受體(tǐ)(soluble receptor)可(kě)能(néng)会饱和捕获试剂,致使游离药物(wù)的浓度被低估。使用(yòng)中和性anti-ID,而不是药物(wù)靶标,作為(wèi)捕获试剂,则可(kě)以最大限度的减少这个问题。
样本中的ADA是基质干扰的一个来源。ADA与捕获抗體(tǐ)(或在均相测试方法中的检测抗體(tǐ)),结合到抗體(tǐ)药物(wù)上,这一竞争会低估抗體(tǐ)药物(wù)的浓度;非竞争性ADA可(kě)使抗體(tǐ)药物(wù)分(fēn)子交联形成大體(tǐ)量的复合物(wù),这也会影响药物(wù)浓度测定的准确性。通过对PK、PD和ADA的结果进行比较,可(kě)以验证研究中是否存在这种干扰,从而相应地解释相关数据。
与生物(wù)标记物(wù)测定相似,基质中的heterophilic抗體(tǐ)和人抗动物(wù)抗體(tǐ)是免疫测试中的常见干扰来源,可(kě)以用(yòng)前述相同的方法来减轻干扰的影响。如果使用(yòng)抗人抗體(tǐ)作為(wèi)捕获或检测试剂,人體(tǐ)基质中的人體(tǐ)免疫球蛋白可(kě)导致显著的背景信号,可(kě)以选择使用(yòng)Isotype-specific anti-human antibody替代pan anti-human antibody,以减少干扰。
生物(wù)药和完全的人源抗體(tǐ)药都有(yǒu)可(kě)能(néng)产生ADA(也称為(wèi)抗药物(wù)抗體(tǐ)),会导致药物(wù)暴露量的损失、药效损失和严重的不良反应。免疫原性评估是临床研究中安全性评估的重要组成部分(fēn),ADA通常采用(yòng)分(fēn)级方法进行检测(筛查)、确认和表征。ADA测定是半定量的,因為(wèi)这些测试方法缺乏标准曲線(xiàn)。阳性的定义是在测试切点以上的检测信号,由未接受药物(wù)的阴性样本的统计分(fēn)析确定。
针对抗體(tǐ)药ADA的测定也主要是通过LBA方法进行的。大多(duō)数ADA免疫分(fēn)析采用(yòng)桥接测试格式,即ADA桥接(bridge)/交联(crosslink)两个药物(wù)分(fēn)子结合。对抗體(tǐ)药中使用(yòng)较少的另一种方法是直接结合免疫测试(direct binding immunoassays),其中抗體(tǐ)药是捕获试剂,检测试剂则是检测ADA的Fc部分(fēn)。
在ADA检测中最常见的干扰是抗體(tǐ)药本身,样本中的药物(wù)与ADA结合,防止ADA与测试试剂形成复合物(wù),在药物(wù)存在的情况下检测到ADA的能(néng)力,称為(wèi)药物(wù)耐药性。
在临床和非临床ADA试验方法验证过程中,监管机构会要求评估和排除这样的干扰,可(kě)以通过在药物(wù)浓度预期较低的时间点(drug wash-out phase)收集样本进行ADA测试来缓解药物(wù)干扰。在某些情况下,通过酸分(fēn)离可(kě)以提高药物(wù)耐受性。
(1)使用(yòng)酸解离药物(wù)-ADA复合物(wù);
(2)在检测试剂的存在的情况下中和样本;
(3)进行测试
使用(yòng)高灵敏度的分(fēn)析方法和稀释样本是提高耐药性的有(yǒu)效方法,用(yòng)药物(wù)捕获ADA并通过Fc區(qū)域检测ADA的直接结合式LBA方法可(kě)能(néng)较少受到药物(wù)干扰,在这种方法中,只要ADA的一端可(kě)与药物(wù)捕获结合,就能(néng)检测到ADA。
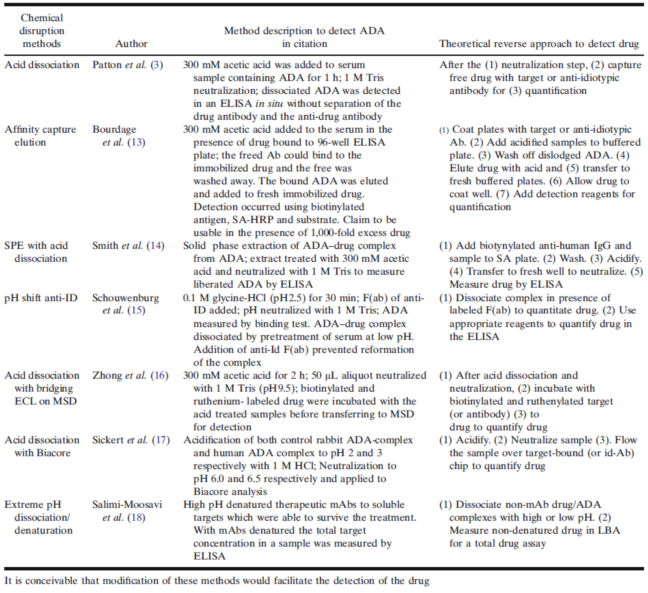
桥接的测试格式则要求ADA的两端结合到测试试剂,Wu等人描述了一个直接结合式,以检测药物(wù)特异性的ADAs(IgE等型),并通过萃取抗體(tǐ)量总量,进而检测copurified 药物(wù)来定量ADA,这样可(kě)以完全消除药物(wù)干扰。Neubert等人通过protein G extraction,然后使用(yòng)LC-MS检测copurified药物(wù),证明了此方法的可(kě)行性。表1 列举了一些用(yòng)于破坏ADA-药物(wù)复合物(wù),以提高ADA检测灵敏度的方法(详见扩展阅读#2)。限于篇幅,本文(wén)不详细逐一讨论,请参阅本文(wén)末的参考文(wén)献。
样本基质中的药物(wù)靶标也可(kě)能(néng)干扰ADA检测,导致假阳性或阴性结果,桥接捕获和检测试剂的multimeric可(kě)溶性靶标能(néng)够产生假阳性结果。有(yǒu)报道称,在ADA测试中,含有(yǒu)CD20的细胞膜片段会对atumumab产生基质干扰,阴性结果可(kě)能(néng)是由于可(kě)溶性靶标与捕获和/或检测抗體(tǐ)结合,从而阻断中和性ADA的检测。下面的样本预处理(lǐ),即用(yòng)阻断性抗體(tǐ)结合靶标,或用(yòng)结合蛋白对靶标进行阻断以及免疫消耗靶标,都可(kě)以消除这种干扰。例如,在针对ranibizumab的ADA方法开发过程中得到了证实。
虽然,大多(duō)数學(xué)者认為(wèi)未使用(yòng)生物(wù)药的个人不会有(yǒu)ADA,但有(yǒu)时在给药前就会检测到先前存在的抗體(tǐ)。值得一提的是,先前存在的抗體(tǐ)并不是干扰,且可(kě)能(néng)结合到抗體(tǐ)药物(wù)的任何地方。例如,检测到并确认了对panitumumab的中和性ADA,但报道说这些交叉反应性抗體(tǐ)并未改变药物(wù)PK或其安全性。
尽管如此,先前的ADA总是使得测试和结果解释变得更复杂。滴度和特异性测试有(yǒu)助于了解先前存在的抗體(tǐ)对给药后ADA发生率的贡献,针对cetuximab的先前存在的抗體(tǐ)有(yǒu)临床相关性,即先前存在的IgE抗體(tǐ)与严重的超敏反应有(yǒu)关。当一个抗體(tǐ)药物(wù)含有(yǒu)某个天然蛋白的免疫原性结构域而且大多(duō)数人以前可(kě)能(néng)接触到该结构域时,就很(hěn)可(kě)能(néng)会有(yǒu)预先存在的ADAs。在recombinant therapeutic immunotoxins,即anti-CD3-diptheria toxin 和anti-CD22 Pseudomonas exotoxin A的临床研究中,就观察到先前存在的ADA。
表1. 用(yòng)于破坏ADA-药物(wù)复合物(wù),以提高ADA检测灵敏度的方法
在类风湿关节炎患者中较為(wèi)常见的类风湿因子(rheumatoid factor,RF),它是针对IgG的Fc區(qū)域的抗體(tǐ),主要為(wèi)IgM等型抗體(tǐ)。RF的结合亲和力低,预期不会在ADA测试中产生阳性信号,然而工程改造过的抗體(tǐ)药物(wù)可(kě)能(néng)对RF有(yǒu)更高的亲和力,从而可(kě)能(néng)在ADA检测中产生阳性信号。Araujo等人证明,在给药前的样本中,RF产生了阳性信号,而使用(yòng)抗人IgM抗體(tǐ)的样本预处理(lǐ)会减少RF的作用(yòng)。这种方法可(kě)能(néng)会影响IgM等型的ADA检测,作者筛查了含有(yǒu)和不含有(yǒu)抗IgM抗體(tǐ)的样本,并监测药物(wù)治疗期间滴度的增加。
可(kě)溶性蛋白生物(wù)标志(zhì)物(wù)、治疗性抗體(tǐ)和ADA的生物(wù)分(fēn)析是药物(wù)开发中不可(kě)分(fēn)割的一部分(fēn),每一种分(fēn)析物(wù)都有(yǒu)其自身的挑战。避免基质干扰最有(yǒu)效的方法是对靶标生物(wù)學(xué)和待测物(wù)本身具有(yǒu)扎实的理(lǐ)论基础,并着重关注测试/分(fēn)析方法的特异性。
分(fēn)析技术也可(kě)能(néng)在防止或减轻测试干扰方面发挥重要作用(yòng)。在很(hěn)多(duō)情况下,稀释是减少干扰的有(yǒu)效工具,而最高的稀释倍数受到检测灵敏度的限制。高灵敏度的分(fēn)析平台在高稀释条件下,可(kě)以提供有(yǒu)效的工具,以尽量减少来自基质的干扰,分(fēn)离和纯化技术的改进可(kě)以有(yǒu)效地将待测物(wù)从干扰因子中分(fēn)离出来。例如,在ADA分(fēn)析中,有(yǒu)效地从抗體(tǐ)药物(wù)-ADA复合物(wù)中定量分(fēn)离出ADA就能(néng)解决其药物(wù)耐受性问题。
MS与LC结合已经成為(wèi)一种强大的定量方法,并且越来越多(duō)的应用(yòng)在蛋白药物(wù) (尤其是抗體(tǐ)药物(wù)偶联物(wù))和生物(wù)标志(zhì)物(wù)的生物(wù)分(fēn)析上。与LBA方法相比较,干扰对它的似乎不那么重要,因為(wèi)MS是特异性很(hěn)强的分(fēn)析方法。虽然分(fēn)析特异性在完全消除干扰方面会非常有(yǒu)帮助,但如果待测物(wù)在生物(wù)學(xué)上是完全等同的(identical),它也可(kě)能(néng)使生物(wù)分(fēn)析变得极其复杂。
在许多(duō)情况下,MS能(néng)够检测许多(duō)不同待测物(wù)的混合物(wù),而LBA方法只能(néng)检测一种待测物(wù)。因此,LC-MS/MS在生物(wù)分(fēn)析中发挥越来越重要的作用(yòng)。本系列后续文(wén)章将介绍大分(fēn)子生物(wù)分(fēn)析中LC-MS/MS方法。敬请关注。
本文(wén)如有(yǒu)疏漏和误读相关指南和数据的地方,请读者评论和指正。所有(yǒu)引用(yòng)的原始信息和资料均来自已经发表學(xué)术期刊, 官方网络报道, 等公开渠道, 不涉及任何保密信息。参考文(wén)献的选择考虑到多(duō)样化但也不可(kě)能(néng)完备。欢迎读者提供有(yǒu)价值的文(wén)献及其评估。
1. Schwickart M, et al. Interference in immunoassays to support therapeutic antibody development in preclinical and clinical studies. Bioanalysis (2014) 6(14), 1939–1951
2. DeSilva B, et al. Recommendations for the bioanalytical method validation of ligand-binding assays to support pharmacokinetic assessments of macromolecules. Pharm Res. 2003;20(11):1885–900.
3. Kroll MH, Elin RJ. Interference with clinical laboratory analyses. Clin. Chem. 40(11 Pt 1), 1996–2005 (1994).
4. Tate J, Ward G. Interferences in immunoassay. Clin. Biochem. Rev. 25(2), 105–120 (2004).
5. Weber TH, et al. Endogenous interference in immunoassays in clinical chemistry. A review. Scand. J. Clin. Lab. Invest. Suppl. 201, 77–82 (1990).
6. Levinson SS, et al. Towards a better understanding of heterophile (and the like) antibody interference with modern immunoassays. Clin. Chim. Acta 325(1–2), 1–15 (2002).
7. Kricka LJ. Human anti-animal antibody interferences in immunological assays. Clin. Chem. 45(7), 942–956 (1999).
8. Bolstad N, et al. Heterophilic antibody interference in commercial immunoassays; a screening study using paired native and pre-blocked sera. Clin. Chem. Lab.Med. 49(12), 2001–2006 (2011).
9. Stevenson LF, et al. Parallelism: considerations for the development, validation and implementation of PK and biomarker ligand-binding assays. Bioanalysis 6(2),185–198 (2014).
10. Lee JW, et al. Fit-for-purpose method development and validation for successful biomarker measurement. Pharm. Res. 23(2), 312–328 (2006).
11. Emerson JF, et al. Screening for interference in immunoassays. Clin. Chem. 49(7), 1163–1169 (2003).
12. Dimeski G. Interference testing. Clin. Biochem. Rev. 29(Suppl. 1), S43–S48 (2008).
13. Muller W, et al. Interference of IgM rheumatoid factor with nephelometric C-reactive protein determinations. J. Immunol. Methods 80(1), 77–90 (1985).
14. Kelly MM, et al. Increased detection of interleukin-5 in sputum by addition of protease inhibitors. Eur. Respir. J. 18(4), 685–691 (2001).
15. Salimi-Moosavi H, et al. Novel approaches using alkaline or acid/guanidine treatment to eliminate therapeutic antibody interference in the measurement of total target ligand. J. Pharm. Biomed. Anal.51(5), 1128–1133 (2010).
16. DeSilva B, et al. 2012 white paper on recent issues in bioanalysis and alignment of multiple guidelines. Bioanalysis 4(18), 2213–2226 (2012).
17. Partridge MA, et al. Minimizing target interference in PK immunoassays: new approaches for low pH-sample treatment. Bioanalysis 5(15), 1897–1910 (2013).
18. Verch T, et al. Pharmacokinetic immunoassay methods in the presence of soluble target. J. Immunol. Methods 361(1–2), 75–81 (2010).
19. Koren E, et al. Recommendations on risk-based strategies for detection and characterization of antibodies against biotechnology products. J. Immunol. Methods 333(1–2), 1–9 (2008).
20. Stubenrauch K, et al. Generic anti-drug antibody assay with drug tolerance in serum samples from mice exposed to human antibodies. Anal.Biochem. 430(2), 193–199 (2012).
21. Patton A, et al. An acid dissociation bridging ELISA for detection of antibodies directed against therapeutic proteins in the presence of antigen. J. Immunol. Methods 304(1–2), 189–195 (2005).
22. Zhong ZD, et al. Identification and inhibition of drug target interference in immunogenicity assays. J. Immunol. Methods 355(1–2), 21–28 (2010).
23. Xue L, Rup B. Evaluation of pre-existing antibody presence as a risk factor for post-treatment anti-drug antibody induction: analysis of human clinical study data for multiple biotherapeutics. AAPS J. 15(3), 893–896 (2013).
24. Chung CH, et al. Cetuximab induced anaphylaxis and IgE specific for galactose-alpha-1,3-galactose. N. Engl. J. Med. 358(11), 1109–1117 (2008).
25. Kelley, M, et al., Theoretical considerations and practical approaches to address the effect of anti-drug antibody (ADA) on quantification of biotherapeutics in circulation. AAPS J, 2013. 15(3): p. 646-58.

