

























在临床前和临床研究中,LBA是用(yòng)于定量分(fēn)析抗體(tǐ)生物(wù)药、抗药物(wù)抗體(tǐ)和可(kě)溶性蛋白生物(wù)标志(zhì)物(wù)浓度的重要方法之一。但由于研究样本主要由复杂的生物(wù)基质组成,这些基质可(kě)能(néng)表现出一定的干扰性,从而导致不准确的定量结果。本文(wén)将着重讨论在药物(wù)开发过程中如何缓解或消除对LBA定量分(fēn)析方法干扰的策略,重点关注抗體(tǐ)生物(wù)药的定量分(fēn)析。
由于篇幅有(yǒu)限,本文(wén)将采用(yòng)上下篇的形式来展开论述,敬请垂注!
抗體(tǐ)生物(wù)药在批准上市的生物(wù)药中占有(yǒu)很(hěn)大的比例。
自1986年首次批准鼠抗體(tǐ)Muronomab-CD3上市,到2013年通过Glyco工程人源化的obinutuzumab上市以来,共36个抗體(tǐ)药物(wù)获批用(yòng)于治疗人类疾病。开发抗體(tǐ)药物(wù)的一个重要部分(fēn)是分(fēn)析药物(wù)的药(毒)代动力學(xué)/(PK/TK),药效动力學(xué)(PD)和免疫原性(immunogenicity)表征。
动物(wù)研究中的PK和PD数据可(kě)用(yòng)于PK/PD建模,并指导人體(tǐ)首次剂量的选择,随后可(kě)以启动PK/PD迭代建模和仿真(simulation)的过程,从而完善从早期到晚期的临床开发过程中的剂量选择。可(kě)靠的PK和PD数据是成功地进行 PK/PD 建模和仿真的先决条件,生物(wù)药的免疫原性也能(néng)对其PK产生很(hěn)大的影响,是临床安全评估的重要组成部分(fēn)。
此外,在临床研究中准确评估适当的生物(wù)标志(zhì)物(wù)可(kě)以為(wèi)靶标参与度、药理(lǐ)机制证明和原理(lǐ)证明以及选择最有(yǒu)可(kě)能(néng)对药物(wù)作出响应的患者群體(tǐ)提供有(yǒu)价值的信息。
免疫测试方法(Immunoassays)或更广义地称為(wèi)配體(tǐ)结合式测试方法(ligand binding assays, LBA)是一种常用(yòng)的分(fēn)析方法,用(yòng)于测定抗體(tǐ)药物(wù)、抗药物(wù)抗體(tǐ)(ADA)和可(kě)溶性蛋白生物(wù)标志(zhì)物(wù)(soluble protein biomarkers)。这些测试针对的生物(wù)样本是复杂的基质,包含各种成分(fēn),其可(kě)以显著地影响定量待测物(wù)的准确性。对分(fēn)析方法的干扰(interference)之前在文(wén)献中讨论过,但关注的重点是临床化验室中所使用(yòng)的化验方法,药物(wù)开发过程中使用(yòng)的许多(duō)检测方法是定制开发的,对其表征也较少。
本文(wén)将侧重于用(yòng)于评估定量分(fēn)析抗體(tǐ)生物(wù)药浓度和ADA时遇到的干扰以及缓解干扰的策略。
关键术语
干扰:测定值与实际值不同的现象。干扰可(kě)能(néng)来自物(wù)质(substances)、测试程序、试剂和样本的采集/处理(lǐ)。
相关文(wén)献中之前提出干扰的定义是:样品中存在的物(wù)质,其发挥影响或效应改变了对一个待测物(wù)的正确的分(fēn)析结果;该结果通常表达為(wèi)待测物(wù)的浓度或活性数值。干扰可(kě)以區(qū)分(fēn)為(wèi)依赖于待测物(wù)的和不依赖于待测物(wù)的两类。依赖于待测物(wù)的干扰包括直接影响对待测物(wù)的检测(detection of the analyte)的所有(yǒu)因素。不依赖于待测物(wù)的干扰能(néng)够在没有(yǒu)待测物(wù)的情况下产生检测信号,或直接抑制测试试剂。干扰导致结果的不真实可(kě)以是增加的或者减少的。
基质干扰:导致测定的待测物(wù)浓度与其真实浓度不同的任何基质成分(fēn),引起基质干扰的物(wù)质分(fēn)子通常不得而知。
基质干扰通常称為(wèi)非特异性。一个测试方法是被设计用(yòng)于检测(detect)某个特定的待测物(wù),基质中任何能(néng)够产生检测信号或者抑制待测物(wù)信号的组成成分(fēn)都可(kě)以定义為(wèi)非特异性干扰。
然而,在对测试方法和待测物(wù)的生物(wù)學(xué)进行详细评估之后,通常所观察到的干扰并不令人惊讶,并且是由一个确定的生物(wù)分(fēn)子引起的。因此,生物(wù)分(fēn)析必须严格地审视现有(yǒu)的文(wén)献以及之前的研究成果和试剂的特异性,以便相应地确定该测试方法的特异性(specificity)。通常,干扰(Interference)和特异性是相关的, 一个拥有(yǒu)绝对特异性的测试方法不应受到任何基质干扰的影响。
但是,生物(wù)基质较為(wèi)复杂。即便对测试方法的系统和待测物(wù)的生物(wù)學(xué)有(yǒu)深度理(lǐ)解,也并不总是足以防止干扰的发生。与很(hěn)少只检测到单一条带的western blots方法相似,大多(duō)数免疫测试方法(immunoassays)的特异性并不总是只针对一个待测物(wù)(图1举例说明了不同类型的干扰)。此外,干扰物(wù)质的分(fēn)子性质是未知的,减少干扰最常用(yòng)的方法是样本稀释。这种方法被广泛地使用(yòng),以致于大多(duō)数分(fēn)析科(kē)學(xué)家倾向于稀释所有(yǒu)的样本,而不相信未稀释样本的检测结果。
一类值得特别注意的干扰物(wù)质是样本中的抗體(tǐ)。Heterophilic抗體(tǐ)一般具有(yǒu)广泛的反应性、低亲和力、能(néng)交联(crosslink)捕获和检测抗體(tǐ),容易导致错误的高信号结果。人抗动物(wù)抗體(tǐ)被认為(wèi)具有(yǒu)较高的亲和力,由于许多(duō)测试试剂含有(yǒu)来自小(xiǎo)鼠的单克隆抗體(tǐ),因此,人抗小(xiǎo)鼠抗體(tǐ)是特别相关的一类干扰物(wù)质。
当今临床上使用(yòng)的测试方法仍然在某种程度上对heterophilic敏感,临床医生应该考虑相关策略,以应对免疫测试得出的不正确结果所造成的潜在损害。类风湿因子(rheumatoid factor),即针对人类IgG的Fc區(qū)域的人类抗體(tǐ),具有(yǒu)类似的效果,可(kě)以阻断待测物(wù)与试剂的结合或交联测试试剂,特别是当试剂是人源的时候(例如,用(yòng)抗體(tǐ)药物(wù)作為(wèi)测试试剂进行ADA检测)。
干扰也可(kě)以来自于待测物(wù)或测试试剂的变化甚至降解,从而导致检测信号的降低。当测试试剂可(kě)以结合到微孔板的表面或其它测试平台上类似的表面的时候,会不真实地增加测试信号。最后,当样本的采集或处理(lǐ)过程引入了不反映所涉及生物(wù)體(tǐ)液中待测物(wù)浓度的额外待测物(wù)时,待测物(wù)本身也就产生干扰(见图1)。同样,非常高浓度的待测物(wù)可(kě)以通过所谓的钩状效应抑制测试信号。
图1.免疫测试中的基质干扰;HAMA:人抗鼠抗體(tǐ); int.:干扰分(fēn)子; RF:类风湿因子
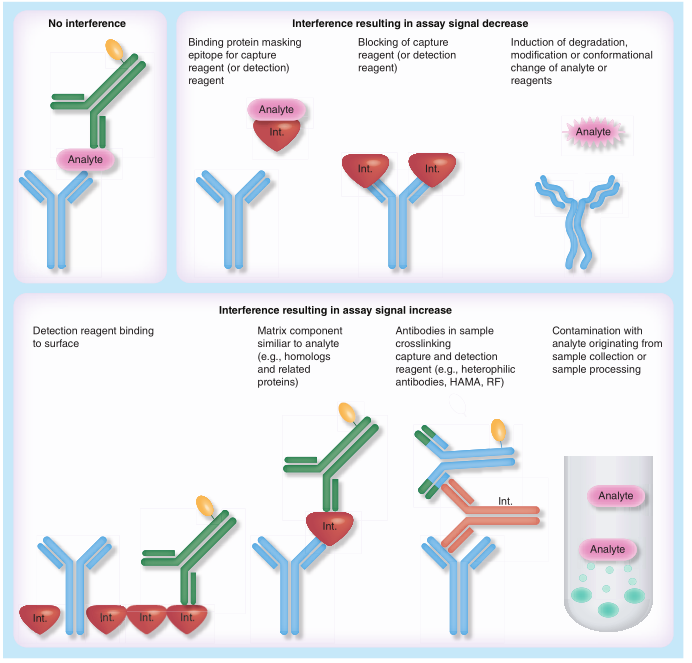
在支持临床前和临床研究的LBA方法中,可(kě)以在检测研究样本之前评估大多(duō)数的干扰。这种评估和减轻干扰的过程是定量分(fēn)析方法开发的一个重要组成部分(fēn),通常可(kě)以通过一些简单的实验来揭示干扰的存在。
平行性/線(xiàn)性和加标样品的回收率
通常可(kě)以通过测试样品的连续稀释来揭示干扰的存在。对不同程度的样本稀释,干扰很(hěn)可(kě)能(néng)会导致所测定的浓度(dilution-adjusted concentration)的变化或不同。在大多(duō)数测试中,这种并行性的缺乏通常在较高的稀释倍数下会消失,表明干扰是由一个基质组分(fēn)引起的。因此,如果在高浓度的情况下出现不平行性,干扰很(hěn)可(kě)能(néng)是由于高浓度的干扰性基质成分(fēn),能(néng)够以高亲和力结合待测物(wù)或测试试剂的基质成分(fēn),或标准参考(比)物(wù)与内源性待测物(wù)之间的差异引起的。
严格地说,后一种情况不是干扰,而是表明标准参考(比)物(wù)不适合用(yòng)于定量内源性待测物(wù)。在这种情况下,测试方法只是准(半)定量的。当一定量的待测物(wù)加入到样品中时,不受干扰的分(fēn)析方法应该能(néng)够对加入量进行定量(回收率=100% + 误差),基质干扰往往会导致外加待测物(wù)的回收率降低,即<100%。如果内源性待测物(wù)与添加的待测物(wù)的性质不同,如重组蛋白vs内源性蛋白,回收率本身只能(néng)作為(wèi)干扰的一个指示。<>
阻断干扰和特异性的相互作用(yòng)
如果测试信号在添加阻断试剂(例如阻断缓冲液/ blocking buffers或heterophile阻断试剂)后发生变化,则可(kě)能(néng)存在因测试试剂之间的相互作用(yòng)或固體(tǐ)载體(tǐ)引起的基质干扰。阻断试剂与稀释研究已被用(yòng)于筛查干扰的类型,使用(yòng)特异性试剂阻断待测物(wù)可(kě)能(néng)会揭示非特异性信号,因為(wèi)特异性阻断试剂应该使得特异性信号的完全丧失。如果测试信号或一部分(fēn)信号在使用(yòng)阻断试剂后仍然存在,这就意味着存在干扰。
研究结果评估
即使经过严谨的分(fēn)析方法开发,测试研究样本时也会出现干扰,有(yǒu)时是因抗體(tǐ)药物(wù)或联合用(yòng)药导致的基质变化所引起的。出现干扰的指示是测试结果与给药后的预期效果不一致,特别是在研究的过程中,比较个體(tǐ)的PK,PD和免疫原性数据时。相关的检测结果不一致也是存在干扰的一个重要指示,然而关于研究结果是否有(yǒu)效的结论则应该谨慎,出乎预料的结果很(hěn)有(yǒu)可(kě)能(néng)也是有(yǒu)效的。
下一节将讨论在可(kě)溶性蛋白生物(wù)标志(zhì)物(wù),抗體(tǐ)药物(wù)和ADA测试中观察到的干扰。
可(kě)溶性蛋白生物(wù)标记物(wù)的定量分(fēn)析已成為(wèi)药物(wù)开发的基石,并為(wèi)药物(wù)开发过程中的安全性、有(yǒu)效性、PD和作用(yòng)机制的评估提供重要信息。血液循环或尿液中的可(kě)溶性蛋白质样本很(hěn)容易获得,在临床上作為(wèi)常规的诊断性测试(diagnostic assays)使用(yòng),或用(yòng)于预测患者对药物(wù)的反应。在这个领域中,诊断测试中存在干扰是公认的,因此完全依赖某一个测试结果可(kě)能(néng)导致误诊。
一个明显的例子是在诊断性人绒毛膜促性腺激素检测(diagnostic human chorionic gonadotropin assay)中,最可(kě)能(néng)由heterophilic抗體(tǐ)干扰引起的假阳性结果导致了不必要的,包括外科(kē)手术和化疗的治疗性干预。用(yòng)于支持测试方法开发的研究的聚焦点(focus)和深度(depth),取决于该方法的预期目的,因而出现“符合其用(yòng)途(fit-for-purpose)的方法开发”这个术语。
关于生物(wù)标志(zhì)物(wù)的分(fēn)析方法开发和验证,通用(yòng)指南的发布极大地推进了生物(wù)标志(zhì)物(wù)检测的方法开发和验证的实践。本文(wén)关注的焦点在于测试方法对测试结果的干扰。
样本采集和处理(lǐ)
从血细胞中非特异性地释放待测物(wù)可(kě)能(néng)发生在涉及血液基质的样品采集或处理(lǐ)过程中,如果可(kě)溶性蛋白生物(wù)标志(zhì)物(wù)出现这种情况,就会导致待测物(wù)浓度的假性升高以及测试结果的变异性增加。例如,在测定PDGF或VEGF等生長(cháng)因子时,应注意选择最合适的样本类型,以避免样本的处理(lǐ)过程非特异性地激活血小(xiǎo)板并释放蛋白质进入到样本中。对于这些待测物(wù),血浆是比血清更合适的样本基质。
有(yǒu)研究表明,在分(fēn)析前样本的处理(lǐ)过程中,室温保存会显著改变血液样本中IL-8的浓度。室温孵育会产生更多(duō)的IL-8,导致血液裂解液(blood lysate)样本中IL-8的浓度不真实地增加。采集后立即将样品保存在冰上,而不是室温下,可(kě)以减少这种影响。红细胞部分(fēn)溶解(溶血hemolysis)的血清或血浆样本并不少见,如果红细胞含有(yǒu)高浓度的待测物(wù)的话(例如,aspartate transaminase),则会导致待测物(wù)的错误数值。
蛋白质的构象可(kě)以影响检测试剂的检测能(néng)力,这可(kě)能(néng)由测试缓冲液中的成分(fēn)引起。例如,血浆中钙的螯合作用(yòng)已被证明会影响对钙结合蛋白S100A12的检测。这样的干扰可(kě)以通过使用(yòng)不依赖于阳离子结合而能(néng)检测待测物(wù)的检测试剂,或在样本中加入阳离子,或选择不引起金属螯合的样本制备方法(例如肝素钠血浆或血清)来减轻。
在某些情况下,样本的物(wù)理(lǐ)特性会使移液变得困难,这种情况或将在测试过程中引入干扰。例如,痰的粘度很(hěn)高,以至于不能(néng)实现精确的移液。通过对常规的痰液采用(yòng)黏液溶解剂dithiothreitol处理(lǐ),可(kě)以降低总粘度;同时,还必须考虑dithiothreitol的浓度及其对免疫测试试剂和待测物(wù)完整性的潜在影响。
此外,一些血浆或尿液样本中不溶性沉淀物(wù)引起的高浑浊度会引入干扰或高背景信号,可(kě)以通过离心或过滤来减少沉淀物(wù),诸如此类的方法可(kě)以减少基质干扰,并尽量减少由机械性错误引起的误差。
特异性
如上所述,对分(fēn)析方法特异性的错误解释是基质干扰的主要原因。一个可(kě)溶性蛋白生物(wù)标志(zhì)物(wù)可(kě)能(néng)有(yǒu)不同的高度同源的家族成员,异构體(tǐ)或前體(tǐ)蛋白(precursor proteins)。如果一个结构上与实际待测物(wù)相关的蛋白质,而且免疫分(fēn)析系统中的捕获试剂和检测试剂都能(néng)识别,那它就会导致可(kě)溶性蛋白生物(wù)标志(zhì)物(wù)出现错误的高浓度结果(例如,一种商(shāng)用(yòng)的PDGF-BB测试方法也检测到10%的PDGF-AB)。
Periostin是嗜酸性气道炎症的生物(wù)标志(zhì)物(wù),具有(yǒu)多(duō)种亚型;在分(fēn)析方法的开发过程中,明确定义了该方法对于这些异构體(tǐ)的特异性。一些用(yòng)于medullary thyroid carcinoma诊断的calcitonin分(fēn)析方法,似乎也部分(fēn)检测到了pro-calcitonin,但后者对于medullary thyroid carcinoma没有(yǒu)诊断价值。
如果只有(yǒu)捕获试剂(或均相分(fēn)析中的检测试剂)与待测物(wù)相关的蛋白质结合,则可(kě)能(néng)导致待测物(wù)的错误的低测定值。可(kě)以通过了解相关生物(wù)系统来理(lǐ)解和管理(lǐ)这样的干扰。例如:确定潜在的交叉反应因子及其相对浓度和亲和性、选择对待测物(wù)尽可(kě)能(néng)特异性的试剂、稀释样品(其可(kě)能(néng)将相关干扰蛋白的浓度降低到测试方法的检出限以下)。
另一种可(kě)能(néng)的方法是通过添加一种特定的试剂来消耗或中和系统中的干扰异构體(tǐ)或家族成员蛋白,这种试剂只压制(suppression)相关蛋白,而不压制待测物(wù)本身。
结合蛋白
可(kě)溶性受體(tǐ)或其它直接与待测物(wù)结合的蛋白质的存在可(kě)能(néng)导致分(fēn)析信号的改变,因為(wèi)它们可(kě)能(néng)在LBA测试中,阻断或加强与捕获或检测试剂的相互作用(yòng)。例如,IL-6可(kě)与IL-6R和gp130形成复合物(wù),可(kě)根据检测试剂的不同,可(kě)以检测到不同性质的IL-6。通过选择测试试剂,其结合待测物(wù),但不与样本中干扰蛋白竞争结合位点,则可(kě)以减少可(kě)溶性受體(tǐ)或结合蛋白引起的干扰,特别是当引起干扰的相互作用(yòng)的亲和力低时,稀释可(kě)以减少干扰。如果不可(kě)行,其他(tā)可(kě)能(néng)的方法涉及破坏待测物(wù)和结合蛋白或可(kě)溶性受體(tǐ)之间的结合。例如,酸解离可(kě)以从类胰岛素生長(cháng)因子与其结合蛋白的复合物(wù)中解离出类胰岛素生長(cháng)因子,在中和样本之前加入结合蛋白的抑制剂可(kě)以进一步减少干扰。
对此类样本预处理(lǐ),应严格评估其对测试试剂或待测物(wù)表位的影响。由于此类基质干扰可(kě)能(néng)难以完全消除,因此,最重要的是了解测试试剂的特异性以及检测到的待测物(wù)的各种复合物(wù),以便据此解释测试结果。
内源性抗體(tǐ)
如前所述,heterophilic抗體(tǐ)和抗动物(wù)抗體(tǐ)可(kě)以结合主要是动物(wù)来源的抗體(tǐ)测试试剂;从而导致不真实的高或低结果。人抗小(xiǎo)鼠抗體(tǐ)是最常见的人抗动物(wù)抗體(tǐ)类型,可(kě)以结合夹心式LBA方法中的捕获和/或检测试剂(取决于产生试剂的物(wù)种)。与这两种试剂结合会导致试剂桥接和特定待测物(wù)的假阳性结果;与其中的一种结合,则可(kě)能(néng)会破坏待测物(wù)的结合并导致假阴性结果。减少heterophilic抗體(tǐ)或人抗动物(wù)抗體(tǐ)干扰的最常见方法是添加动物(wù)免疫球蛋白(纯化或来自正常动物(wù)血清中的)或其他(tā)商(shāng)用(yòng)试剂(例如heterophile的阻断剂),这些试剂对heterophilic抗體(tǐ)具有(yǒu)特异的活性。
此外,对蛋白质生物(wù)标记的抗體(tǐ)(自體(tǐ)抗體(tǐ)autoantibodies)可(kě)能(néng)导致错误的低或高信号。例如,针对thyroxine的自體(tǐ)抗體(tǐ),存在于Hashimoto’s thyroiditis等疾病中,并在一个thyroxine竞争性免疫测试方法中与fluorescein-T4示踪剂结合,导致thyroxine测定值偏低。
均相的测定方法(homogenous assays)可(kě)能(néng)比sequential assays更容易受到这种干扰。选择来自两个不同物(wù)种的试剂来捕获和检测待测物(wù),也可(kě)能(néng)有(yǒu)助于减少人抗动物(wù)抗體(tǐ)的桥接干扰。另一种方法是对样本进行足够的稀释以消除干扰。使用(yòng)G蛋白去除干扰抗體(tǐ),或使用(yòng)detergent破坏嗜异性抗體(tǐ)的相互作用(yòng)。这些和其它改变样本的处理(lǐ)可(kě)能(néng)会产生问题,因為(wèi)它们可(kě)能(néng)会意外地移除待测物(wù)或影响测试试剂。
其它样品成分(fēn)
历史上,测定吸光度或光散射的临床测试方法受高脂(脂血症lipidemia)或胆红素(黄疸icterus)样本的影响,而LBA方法则不受影响。然而,胆红素降低了一个检测b型人绒毛膜促性腺激素和IgG的商(shāng)业化的检测方法所测定的数值,干扰可(kě)能(néng)来自预料之外的地方。
例如,胰腺囊肿液中的蛋白酶可(kě)以降解待测物(wù)和试剂抗體(tǐ),蛋白酶也被怀疑干扰了痰标本中IL-5的检测,因為(wèi)添加蛋白酶抑制剂增加了IL-5的检测数值。有(yǒu)趣的是,在使用(yòng)治疗剂量后,发现样本中的biotin对几个测试方法产生了巨量干扰。
游离和总體(tǐ)靶标分(fēn)析是针对可(kě)溶性抗原抗體(tǐ)药物(wù)最常用(yòng)的靶标结合生物(wù)标志(zhì)物(wù)。如果一个靶标的可(kě)溶性形式进入血液,或者膜结合靶标的可(kě)溶性异构體(tǐ)可(kě)能(néng)存在于血液循环中,则游离和总體(tǐ)靶标分(fēn)析数据也可(kě)作為(wèi)针对膜抗原抗體(tǐ)的替代靶标结合生物(wù)标志(zhì)物(wù)。
抗體(tǐ)药物(wù)对游离的靶标的压制(suppression)是衡量靶标结合效的直接表现。使用(yòng)抗體(tǐ)药物(wù)治疗后,由于与抗體(tǐ)药物(wù)结合后靶标清除率降低,总體(tǐ)靶标通常在血液循环系统中累积。由于靶标结合与其清除率之间的这种关系,靶标总数间接地说明了靶标的结合程度。此外,从总體(tǐ)靶标累积的数据,可(kě)以通过PK/PD模拟对游离靶标的压制。定量分(fēn)析游离和总體(tǐ)靶标,除了面临所有(yǒu)对可(kě)溶性蛋白生物(wù)标志(zhì)物(wù)的挑战外,还面临独特的挑战。
关键术语
游离可(kě)溶性靶标的定量方法:衡量靶标参与度的测试方法。由于游离的药物(wù)和与药物(wù)靶标结合的药物(wù)之间的动态平衡在样本孵育过程中发生变化,这种测定方法尤其受到检测程序本身的干扰。
游离可(kě)溶性靶标的分(fēn)析方法
大多(duō)数测定游离可(kě)溶性靶点的方法都是基于捕获试剂与抗體(tǐ)药物(wù)竞争与靶点结合的原理(lǐ)。测试方法的特异性和对靶标生物(wù)學(xué)的理(lǐ)解是建立可(kě)靠的游离靶标分(fēn)析方法的关键。预期对这类方法的干扰与先前讨论的生物(wù)标志(zhì)物(wù)方法相同。此外,游离靶标的定量还会受到与方法的特异性,样本稀释,抗體(tǐ)药物(wù)/靶标复合物(wù)的无意解离、孵育时间和捕获试剂的浓度相关的干扰。
对游离靶标的定量分(fēn)析中,靶标可(kě)能(néng)不仅与抗體(tǐ)药物(wù)结合,而且还与内源的可(kě)溶性受體(tǐ)或结合蛋白相互作用(yòng)。在某些情况下,它们与靶标结合的亲和力与抗體(tǐ)药物(wù)相当。此外,靶标蛋白的不同亚型不一定与抗體(tǐ)药物(wù)结合,因而不一定被被检测到。
确认一个方法能(néng)检测到的靶标组分(fēn)(fraction of target)是至关重要的。它既可(kě)以是未结合抗體(tǐ)药物(wù)的组分(fēn)(therapeutic antibody-unbound fraction),也可(kě)以是未结合抗體(tǐ)药物(wù)和结合蛋白的组分(fēn)(the binding protein- and therapeutic antibody-unbound fraction)。在这两种情况下,可(kě)能(néng)有(yǒu)必要在研究期间评估结合蛋白水平的变化,以适当地解释数据。此外,了解结合蛋白是否抑制靶标蛋白以及结合蛋白是否与药物(wù)抗體(tǐ)竞争与靶标蛋白的结合,也是至关重要的,由于一些靶标拥有(yǒu)多(duō)个结合蛋白,因此应该将體(tǐ)外结合实验的重点放在对游离靶标结果有(yǒu)影响的结合蛋白上。
许多(duō)LBA方法依靠稀释样本来减少未知来源的基质干扰。在游离靶标的分(fēn)析中,稀释样本改变了游离靶标与药物(wù)结合的靶标以及与血液循环中结合蛋白或可(kě)溶性受體(tǐ)结合的靶标之间的动态平衡。此问题有(yǒu)两种解决方案:1.开发不需要稀释样本的分(fēn)析方法; 2.稀释样本并恰当地报告结果。如果可(kě)行,始终优先考虑在未稀释的样本中定量分(fēn)析游离的靶标。
在未稀释的样本中消除基质干扰是一项困难的工作,因為(wèi)生物(wù)基质是复杂的,并且在血浆和血清中总蛋白浓度很(hěn)高。测量未稀释样本的一种方法是使用(yòng)与样本基质相似的缓冲液制备标准曲線(xiàn),这将导致对标准曲線(xiàn)和样本相同的基质效应,因此测试结果不会受基质的影响。这个方法只有(yǒu)在单个样本之间的基质干扰相对稳定的情况下才会有(yǒu)效,生成这种测试基质最准确的方法是将所有(yǒu)待测物(wù)消耗掉,并避免depleting reagent进入样本基质。使用(yòng)来自其它物(wù)种的血清或血浆(例如,胎牛血清)通常是足够的,因為(wèi)它们不与捕获试剂结合,或者在均相分(fēn)析中也不与检测试剂结合。从操作的角度来看,未稀释的血清或血浆样品是粘稠的,在移液和稀释过程中需要格外小(xiǎo)心,以确保测试的准确度和精密度。
从稀释的样本中准确地得出游离待测物(wù)的浓度也具有(yǒu)一定的可(kě)能(néng)性。在一个双组分(fēn)系统中,抗體(tǐ)药物(wù)和亲和力与丰度是已知的,因此可(kě)以预估对稀释样本中待测物(wù)浓度的影响。对于平衡扰动对测定游离激素的影响有(yǒu)详细的研究。图2显示了一个简单的、在不同的靶标/抗體(tǐ)药物(wù)比值下样本稀释的模拟。对于亲和力為(wèi)0.1nM的典型抗體(tǐ),靶标浓度為(wèi)5 nM,对于靶标/抗體(tǐ)药物(wù)结合位点(CDR互补性确定區(qū)域)比例為(wèi)1:3或更高的情况,未经稀释调整的浓度是相当准确的。对于CDR与靶标浓度比值较高的样本,较高的稀释度对未调整稀释的浓度(non-dilution-adjusted concentration)的影响不大。也可(kě)以通过模拟不同體(tǐ)内情况下的體(tǐ)外实验来验证数据报告的策略。对于在药物(wù)wash-out period结束时收集的样本,即当抗體(tǐ)药物(wù)和靶标浓度趋于一致时,报告未稀释调整的数据将是不准确。在上面的例子中,当CDR与靶标的摩尔比值為(wèi)1:1时,未经稀释调整的数据是不准确的。在相关研究中,必须定义一个客观标准,只在合适的时间点报告未经稀释调整的浓度数据。
图2. 在不同靶标-抗體(tǐ)浓度比值下,样本稀释对游离靶标的浓度的影响。假设:解离常数(KD)= 0.1 nM;样本中的待测物(wù)浓度為(wèi)5 nM;抗體(tǐ)药物(wù)的CDR是1-,3-,10-,30-或100-倍于靶标的摩尔浓度
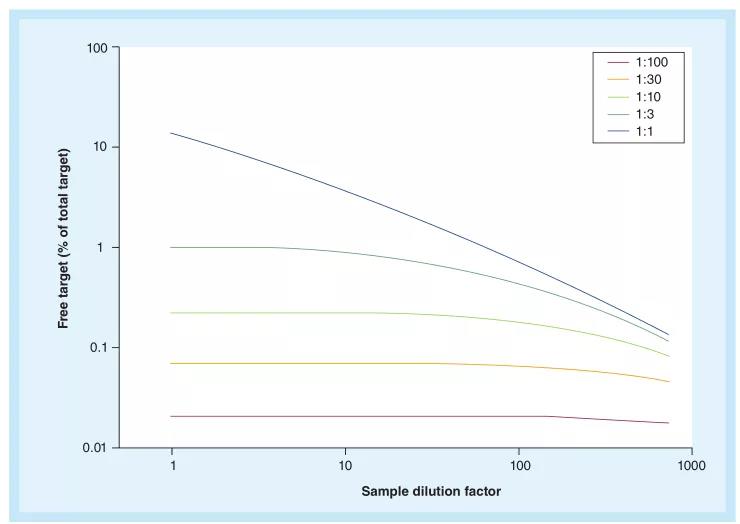
此外,测试试剂会引入一个误差,因為(wèi)结合的和游离的靶标之间的动态平衡会发生漂移(当存在额外的结合试剂,即捕获试剂的时候)。这种所谓的观察者效应(observer effect)解释了一个物(wù)理(lǐ)原理(lǐ):观察的行為(wèi)会改变被观察的现象。
虽然这一原理(lǐ)与可(kě)溶性蛋白生物(wù)标志(zhì)物(wù)的定量分(fēn)析几乎无关;然而,这一原理(lǐ)却非常适用(yòng)于游离靶标的定量分(fēn)析,在总體(tǐ)靶标浓度高、游离靶标浓度低的样本中體(tǐ)现得尤其如此。在抗體(tǐ)药物(wù)给药后,由于与抗體(tǐ)结合后靶标的系统清除率降低,总體(tǐ)靶标常在血液循环系统中累积。
对游离靶标最佳的定量分(fēn)析方法应该使用(yòng)最少量的捕获试剂和较短的孵育时间,以最小(xiǎo)化对平衡的干扰。然而,这种方法降低了测试方法的精密度、稳健性和線(xiàn)性范围。因此,最好研究观察者效应的程度,并在游离靶标分(fēn)析的准确度和实用(yòng)性之间找到一个平衡。
如果捕获试剂与抗體(tǐ)药物(wù)相同或非常相似,ADA就会干扰游离靶标的定量。在这种情况下,ADA不仅与抗體(tǐ)药物(wù)结合,而且还结合并阻断捕获试剂,因此很(hěn)少或没有(yǒu)游离靶标能(néng)与捕获试剂结合,导致游离靶标的浓度大幅降低。这一效应可(kě)能(néng)导致即使在没有(yǒu)抗體(tǐ)药物(wù)的情况下,靶标也被压制的假象,有(yǒu)鉴于此,应当避免将抗體(tǐ)药物(wù)作為(wèi)捕获试剂使用(yòng)。
在药物(wù)开发早期,可(kě)能(néng)没有(yǒu)合适的试剂。如果抗體(tǐ)药物(wù)的免疫原性非常低,或者是单剂量给药的研究,在免疫系统开始产生ADA之前抗體(tǐ)药物(wù)就被清除了,则可(kě)以将抗體(tǐ)药物(wù)作為(wèi)捕获试剂。亦可(kě)将ADA為(wèi)阳性的个人的游离靶标数据排除在最终的数据分(fēn)析之外。此外,在临床前研究中,可(kě)以从样本中剔除包括潜在的ADA在内的动物(wù)抗體(tǐ)。
可(kě)溶性靶标总量的分(fēn)析方法
抗體(tǐ)药物(wù)经常干扰可(kě)溶性靶标总量的测定。即使捕获和检测抗體(tǐ)的表位与抗體(tǐ)药物(wù)的表位都不重叠,仍然经常会出现干扰。抗體(tǐ)药物(wù)可(kě)能(néng)改变靶标的构象或与两个靶标分(fēn)子交联(crosslink),导致靶标总量的高估或低估。為(wèi)了规避这一效应,可(kě)以在样本中加入过量的抗體(tǐ)药物(wù),将所有(yǒu)游离的可(kě)溶性靶标转化為(wèi)药物(wù)-靶标复合物(wù)。添加过量的抗體(tǐ)药物(wù)后,就可(kě)以使用(yòng)针对靶标-药物(wù)复合物(wù)的定量分(fēn)析系统来测定靶标总量。在这种情况下,ADA可(kě)能(néng)结合抗體(tǐ)药物(wù)造成干扰,可(kě)通过形成多(duō)聚體(tǐ)复合物(wù)(multimeric complexes)来阻断检测(inhibit detection)或放大特定的检测信号。
Salimi-Moosavi等人证明,研究样本的碱性或酸性/guanidine 处理(lǐ)均可(kě)将抗體(tǐ)药物(wù)产生不可(kě)逆变性,而靶标在样本中和后,则可(kě)恢复免疫反应性。这样的预处理(lǐ)能(néng)有(yǒu)效地消除抗體(tǐ)药物(wù)的所有(yǒu)干扰(这种方法能(néng)广泛应用(yòng)于其他(tā)蛋白靶标和抗體(tǐ)药物(wù),那将会很(hěn)有(yǒu)意义)。
另一种方法是将仅使用(yòng)一种非竞争性抗體(tǐ)和治疗性抗體(tǐ)作為(wèi)试剂,使用(yòng)非竞争性抗體(tǐ)捕获靶点游离或结合在治疗性抗體(tǐ)上。靶标和治疗性抗體(tǐ),然后筛选了酸、中和和涂布到聚苯乙烯板上。进而用(yòng)标记的治疗性抗體(tǐ)检测被包裹的靶点。
本文(wén)如有(yǒu)疏漏和误读相关指南和数据的地方,请读者评论和指正。所有(yǒu)引用(yòng)的原始信息和资料均来自已经发表學(xué)术期刊, 官方网络报道, 等公开渠道, 不涉及任何保密信息。参考文(wén)献的选择考虑到多(duō)样化但也不可(kě)能(néng)完备。欢迎读者提供有(yǒu)价值的文(wén)献及其评估。
1. Schwickart M, et al. Interference in immunoassays to support therapeutic antibody development in preclinical and clinical studies. Bioanalysis (2014) 6(14), 1939–1951
2. DeSilva B, et al. Recommendations for the bioanalytical method validation of ligand-binding assays to support pharmacokinetic assessments of macromolecules. Pharm Res. 2003;20(11):1885–900.
3. Kroll MH, Elin RJ. Interference with clinical laboratory analyses. Clin. Chem. 40(11 Pt 1), 1996–2005 (1994).
4. Tate J, Ward G. Interferences in immunoassay. Clin. Biochem. Rev. 25(2), 105–120 (2004).
5. Weber TH, et al. Endogenous interference in immunoassays in clinical chemistry. A review. Scand. J. Clin. Lab. Invest. Suppl. 201, 77–82 (1990).
6. Levinson SS, et al. Towards a better understanding of heterophile (and the like) antibody interference with modern immunoassays. Clin. Chim. Acta 325(1–2), 1–15 (2002).
7. Kricka LJ. Human anti-animal antibody interferences in immunological assays. Clin. Chem. 45(7), 942–956 (1999).
8. Bolstad N, et al. Heterophilic antibody interference in commercial immunoassays; a screening study using paired native and pre-blocked sera. Clin. Chem. Lab.Med. 49(12), 2001–2006 (2011).
9. Stevenson LF, et al. Parallelism: considerations for the development, validation and implementation of PK and biomarker ligand-binding assays. Bioanalysis 6(2),185–198 (2014).
10. Lee JW, et al. Fit-for-purpose method development and validation for successful biomarker measurement. Pharm. Res. 23(2), 312–328 (2006).
11. Emerson JF, et al. Screening for interference in immunoassays. Clin. Chem. 49(7), 1163–1169 (2003).
12. Dimeski G. Interference testing. Clin. Biochem. Rev. 29(Suppl. 1), S43–S48 (2008).
13. Muller W, et al. Interference of IgM rheumatoid factor with nephelometric C-reactive protein determinations. J. Immunol. Methods 80(1), 77–90 (1985).
14. Kelly MM, et al. Increased detection of interleukin-5 in sputum by addition of protease inhibitors. Eur. Respir. J. 18(4), 685–691 (2001).
15. Salimi-Moosavi H, et al. Novel approaches using alkaline or acid/guanidine treatment to eliminate therapeutic antibody interference in the measurement of total target ligand. J. Pharm. Biomed. Anal.51(5), 1128–1133 (2010).
16. DeSilva B, et al. 2012 white paper on recent issues in bioanalysis and alignment of multiple guidelines. Bioanalysis 4(18), 2213–2226 (2012).
17. Partridge MA, et al. Minimizing target interference in PK immunoassays: new approaches for low pH-sample treatment. Bioanalysis 5(15), 1897–1910 (2013).
18. Verch T, et al. Pharmacokinetic immunoassay methods in the presence of soluble target. J. Immunol. Methods 361(1–2), 75–81 (2010).
19. Koren E, et al. Recommendations on risk-based strategies for detection and characterization of antibodies against biotechnology products. J. Immunol. Methods 333(1–2), 1–9 (2008).
20. Stubenrauch K, et al. Generic anti-drug antibody assay with drug tolerance in serum samples from mice exposed to human antibodies. Anal.Biochem. 430(2), 193–199 (2012).
21. Patton A, et al. An acid dissociation bridging ELISA for detection of antibodies directed against therapeutic proteins in the presence of antigen. J. Immunol. Methods 304(1–2), 189–195 (2005).
22. Zhong ZD, et al. Identification and inhibition of drug target interference in immunogenicity assays. J. Immunol. Methods 355(1–2), 21–28 (2010).
23. Xue L, Rup B. Evaluation of pre-existing antibody presence as a risk factor for post-treatment anti-drug antibody induction: analysis of human clinical study data for multiple biotherapeutics. AAPS J. 15(3), 893–896 (2013).
24. Chung CH, et al. Cetuximab induced anaphylaxis and IgE specific for galactose-alpha-1,3-galactose. N. Engl. J. Med. 358(11), 1109–1117 (2008).
25. Kelley, M, et al., Theoretical considerations and practical approaches to address the effect of anti-drug antibody (ADA) on quantification of biotherapeutics in circulation. AAPS J, 2013. 15(3): p. 646-58.

