上周,“袁来如此”专栏就大分(fēn)子生物(wù)分(fēn)析方法的校准曲線(xiàn)的设计、生成和编辑的思考和建议展开了详细介绍(袁来如此|大分(fēn)子生物(wù)分(fēn)析概论(四_上):校准曲線(xiàn)的设计,生成和编辑),本期将延续上期内容,重点介绍大分(fēn)子生物(wù)分(fēn)析方法校准曲線(xiàn)拟合模型和权重进行取舍的方法。
本系列文(wén)章介绍的生物(wù)分(fēn)析是指定量地测定在动物(wù)和人體(tǐ)體(tǐ)液或组织中的生物(wù)药(本文(wén)特指蛋白质类生物(wù)药,包括单抗,细胞因子,生長(cháng)素,融合蛋白等)的浓度。大多(duō)数生物(wù)分(fēn)析方法都基于免疫测试方法(Immunoassays),或者更广义地称為(wèi),配體(tǐ)结合式测试方法(ligand binding assays, LBA)。这些方法涉及一系列试剂的使用(yòng),如抗药物(wù)抗體(tǐ),其它抗體(tǐ),生物(wù)药的靶标蛋白等。
配體(tǐ)结合式测试方法(LBA,也称為(wèi)immunoassays)是一种常用(yòng)的定量分(fēn)析工具。在LBA方法中,待测物(wù)浓度与响应数据之间的关系是质量作用(yòng)定律驱动的非線(xiàn)性关系,两个被广泛接受和经过验证的LBA校准曲線(xiàn)的回归模型是4参数logistic(4PL)和5参数logistic(5PL)曲線(xiàn)拟合模型。选择适当的回归模型和权重函数是LBA方法开发的关键组成部分(fēn)。
在分(fēn)析方法开发期间,应对选定的模型和权重函数进行评估,并在验证期间加以确认。关于确定或选择适当的回归模型和权重函数的实际操作方法,在已发表的文(wén)献中颇為(wèi)有(yǒu)限,本文(wén)将提出一个结构化的、有(yǒu)序的方案来确定两者。
在LBA中观察到的实验响应是一个配體(tǐ)(待测物(wù))和检测系统中使用(yòng)的特定捕获/检测试剂的平衡结合的结果。实验响应与对数变换后浓度之间的这种关系是非線(xiàn)性的,使得典型的LBA校准曲線(xiàn)為(wèi)全部或部分(fēn)的S型(sigmoidal)。常见的非線(xiàn)性回归模型為(wèi)4PL和5PL,拟合模型的选择可(kě)能(néng)由曲線(xiàn)的形状所驱动。完全的 sigmoidal曲線(xiàn)(其中顶部和底部平台區(qū)是镜像)通常使用(yòng)4PL 模型。部分(fēn)sigmoidal曲線(xiàn),即非对称曲線(xiàn),通常使用(yòng)5PL模型(4PL、5PL模型详细解读请戳《袁来如此|大分(fēn)子生物(wù)分(fēn)析概论(四_上):校准曲線(xiàn)的设计,生成和编辑》)。
由于LBA中配體(tǐ)平衡结合(equilibrium binding)的特性,经常会观察到测试响应的非恒定的方差(non-constant variance of response),这种不等同方差称為(wèi)异方差性(heteroscedasticity)。如果在曲線(xiàn)拟合时不考虑应对异方差性,则可(kě)能(néng)导致最终结果中出现回算错误和更大的偏差。為(wèi)了减少异方差性的影响并提高曲線(xiàn)拟合的质量,必须尽量减少具有(yǒu)较高方差(higher variance)的校准点对曲線(xiàn)拟合的贡献,广义最小(xiǎo)平方 (generalized least squares)和方差稳定变换(variance stabilizing transformation)可(kě)以用(yòng)来解决这个问题。这些方法要么在每个拟合迭代后更新(xīn)权重函数;要么转换数据和模型,以使用(yòng)普通最小(xiǎo)平方模型,而不使用(yòng)权重函数。在已发表的方法中,線(xiàn)性回归斜率方法(linear regression slope approach)可(kě)能(néng)是最实用(yòng)的。本文(wén)下面讨论这个方法。
大多(duō)数与 LBA测试相关的软件為(wèi)各种拟合模型和常用(yòng)的权重函数(如 1/Y 或 1/Y2)提供了内置的选择。相关监管指南建议使用(yòng)最简单,并充分(fēn)描述了待测物(wù)浓度与其响应之间关系的模型。在选择回归模型(加或不加权重)时,如果对曲線(xiàn)形状的目视评估和对使用(yòng)的统计方法进行比较,如比较F测试和chi-square p value,并不容易,其结果可(kě)能(néng)会令人困惑。这里常见的挑战是如何依据相关知识,合理(lǐ)地选择其中之一。
本文(wén)将介绍一组案例研究,其中采用(yòng)药代动力學(xué)定量分(fēn)析方法,用(yòng)于血清或血浆中蛋白生物(wù)药的定量,以及使用(yòng)通用(yòng)的统计软件来确定适当的拟合模型和权重因子。
LBA方法是评估生物(wù)药的PK/TK时的主要定量分(fēn)析方法,该方法的特异性和选择性取决于目标待测物(wù)与其他(tā)生物(wù)分(fēn)子(如受體(tǐ)、和针对候选生物(wù)药的抗體(tǐ))的相互作用(yòng)。LBA方法中观察到的信号/响应与生物(wù)药的浓度间接相关。
下面的示例A、B和C都使用(yòng)了LBA方法,如電(diàn)化學(xué)发光(ECL)检测平台或比色法ELISA检测平台,用(yòng)于定量分(fēn)析血浆或血清(人或食蟹猴)中的蛋白生物(wù)药浓度。每个案例研究中的分(fēn)析方法简述如下:
案例A:对Meso Scale Discovery(MSD)Multi-Array®微孔板,使用(yòng)单克隆抗药物(wù)抗體(tǐ)(5 g/mL)包板,过夜;之后,与含有(yǒu)药物(wù)的样品在室温下孵育60分(fēn)钟;洗板后,结合到板上的药物(wù)与biotinylated单克隆检测抗體(tǐ)(2.5g/mL)孵育60分(fēn)钟;然后加入0.1g/mL 的Streptavidin-ruthenium,再孵育60分(fēn)钟;之后,MSD仪器在特定条件下检测到来自ruthenium 的電(diàn)化學(xué)发光信号。
案例B:对streptavidin 包被的MSD Multi-Array®微孔板,在室温下,以biotinylated单克隆抗體(tǐ)(4mg/mL)包板60至120分(fēn)钟;随后,含有(yǒu)药物(wù)的样品在上述微孔板上孵育90分(fēn)钟;使用(yòng)小(xiǎo)鼠抗人IgG Fc-Ruthenium(0.36mg/mL)孵育60分(fēn)钟,以结合被抗體(tǐ)捕获的生物(wù)药;之后,MSD仪器在特定条件下检测到来自ruthenium 的電(diàn)化學(xué)发光信号。
案例C:在Costar微孔板上,在4°C包被药物(wù)靶点(4 mg/mL),过夜;与靶点结合后的生物(wù)药,再与50 ng/mL的biotinylated单克隆抗體(tǐ)孵育60分(fēn)钟;之后,再与1:50,000稀释后的avidin D-HRP 孵育60分(fēn)钟;随后,加入HRP酶底物(wù),TMB,以产生色度反应;然后用(yòng)硫酸停止该反应,并在酶标仪Spectramax上,测量450nm的光學(xué)密度(OD)。
异方差性(Heteroscedasticity)
在采集到的实验运行的标准校准数据集合(standard calibration data)中,可(kě)以通过观察测试信号的标准偏差(SD)和校准点浓度之间的关系来评估异方差性。為(wèi)此,分(fēn)别评估了案例A、B和C在方法开发过程中获得的6、7和10个独立运行。
首先,使用(yòng)Microsoft Excel 2010计算标准方差,其次使用(yòng) GraphPad Prizm 7 来绘制每个校准品测试信号的SD与校准点浓度的关系图。在目视考查了SD变化的趋势后,就可(kě)以确定对权重函数的需求。如果SD发生移动,则表明了异方差性,因此,需要使用(yòng)权重函数。如果SD在校准品浓度范围内是恒定的,则无需加权。
当在校准曲線(xiàn)中观察到测试信号的标准偏差随浓度发生变化时,就需要对更精确的数据点(具有(yǒu)较低SD的数据)使用(yòng)权重函数来调整曲線(xiàn)的拟合。在 GraphPad Prizm 7 中,可(kě)以使用(yòng)图形線(xiàn)性回归方法(graphical linear regression approach)计算权重函数因子如下:
步骤1. 绘制下述二者的关系图:对数转换后的测试信号平均值与对数转换后的SD,对二者使用(yòng)相同的对数底数(10或2)。
步骤2. 在步骤1中得到的線(xiàn)性回归直線(xiàn)的斜率值(k)乘以2,以确定权重函数因子(weighting function factor),即2k。
為(wèi)了平衡所有(yǒu)校准点的贡献,在4PL或5PL曲線(xiàn)拟合中应用(yòng)权重函数 1/Y2k(其中Y是测试信号,2k是权重因子),以尽量减少weighted sum-of-squares,从而获得更好的准确度和精密度。
将权重函数 1/Y2k 应用(yòng)于曲線(xiàn)拟合模型 (4PL 或 5PL)后,再使用(yòng)Watson LIMS,将回算的校准点浓度插入加权拟合的曲線(xiàn)(假定这些校准点是未知浓度的样本)。
如果对所有(yǒu)测试运行和对每个标准校准点(锚定点除外),累积%RE在±15% 之内并且累积%CV≤15%,则回归模型是可(kě)以接受的;但对于定量下限(LLOQ)和上限(ULOQ),接受标准一般 %RE±20和累积 %CV≤20。估计的定量范围(ROQ)是在符合上述接受标准的最低和最高标准浓度之间确定的。在 MS Excel 2010 中,累计%RE和累积%CV 分(fēn)别计算為(wèi):[100 - 100 x(回算浓度的平均值/标称浓度)]和 100 X(回算浓度的标准方差/回算浓度的平均值)。
之后,使用(yòng) GraphPad Prizm 7 绘制 4PL 和 5PL 之间准确度(累积cumulative %RE)和精密度(累积cumulative %CV)的比较图。回归模型的适宜性可(kě)使用(yòng)此可(kě)视化图形工具来判断:在可(kě)接受的范围内包含了更多(duō)标准校准点,而且累积 %RE 和累积 %CV 较低模型,就是应该选择的模型。如果两种模型的效能(néng)非常相似,则可(kě)通过是否具有(yǒu)加权4PL来做选择 ,因為(wèi)一般遵循 Occam’s razor 原则, 即以最少的假设,发现数据和模型之间的关系。
图1. 选择曲線(xiàn)拟合模型以提高曲線(xiàn)性能(néng)的方法。实际工作流程描述了选择权重函数和曲線(xiàn)拟合模型的每个步骤和整个过程。
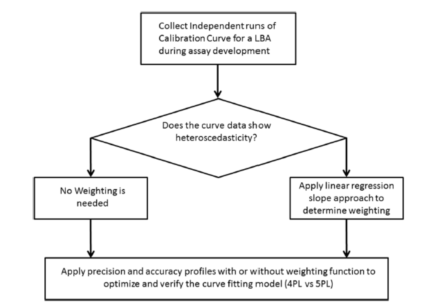
本文(wén)提出了一种结构化的方法,通过选择正确的曲線(xiàn)拟合模型和权重函数,以扩展 LBA分(fēn)析方法的定量范围(图1)。该方法完全从数學(xué)的角度出发,确定一条校准曲線(xiàn)是否需要加权重以及哪种加权方式最合理(lǐ)。如果收集到的数据中呈现出的异质性,则在准确度和精密度行為(wèi)方面,对4PL和5PL两个模型(以及确定的权重函数)进行比较;如果未观察到异方差性,则对不含权重量4PL和5PL模型进行比较。以下将此原则应用(yòng)于3个典型 LBA分(fēn)析案例。在这3个生物(wù)药的药代动力學(xué)(PK)研究案例中,总共开发了3个分(fēn)析方法,并观察到3种不同形状的校准曲線(xiàn)。其中,两个分(fēn)析方法(案例A和B)利用(yòng)了電(diàn)化學(xué)发光(ECL)平台,而另一个分(fēn)析方法(案例C)使用(yòng)了比色ELISA平台。
為(wèi)了在方法开发过程中对浓度-测试信号的关系进行详细研究,表1中描述了定量分(fēn)析生物(wù)药A、B和C浓度的3条校准曲線(xiàn)。在预期的定量范围内(对数尺度上),校准点大致均匀分(fēn)布。
表1. 3条PK校准曲線(xiàn)的特征总结

用(yòng)于评估各自PK分(fēn)析运行的校准曲線(xiàn)数据如图2所示。在所有(yǒu)3个案例研究中都观察到了典型的非線(xiàn)性的浓度-响应曲線(xiàn)。
图2. 3个案例研究中的校准曲線(xiàn):案例 A(a),案例 B(b) 和案例 C(c)。该图展示了3条标准曲線(xiàn)的形状,代表了在LBA测试中通常观察到的典型非線(xiàn)性响应。X轴代表校准点浓度的对数,Y轴代表响应读数:案例A和B是相对光单位(RLU),案例C是450 nM 光學(xué)密度(OD 450)。
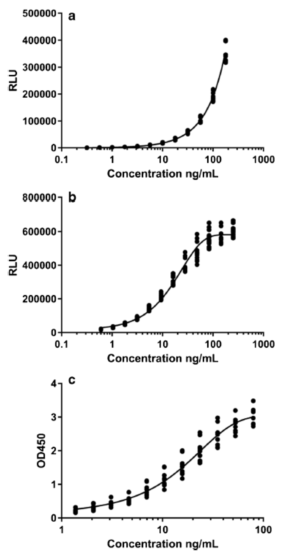
图3. 案例A(a)、案例B(b)和案例C(c)的异方差性概况。X轴代表校准点浓度的对数,Y轴代表实验运行中测试信号的SD。
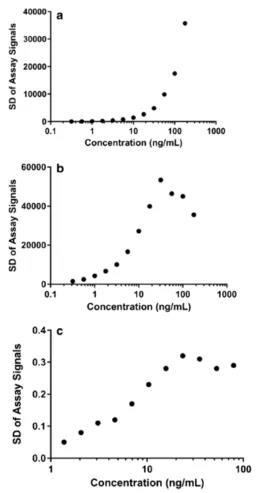
下面评估了表1中3条校准曲線(xiàn)上测试信号的标准偏差(SD),该SD是异方差性的直接指标。这3条校准曲線(xiàn)上测试信号的SD(变异性variability)不是恒定的,而是随着校准点的浓度而改变化的(图3)。
对于案例A,当药物(wù)浓度超过 20 ng/mL时,其变异性急剧增加。在案例B中,SD大幅增加,直到48.3 ng/mL的浓度,并在 48.3和 250 ng/mL 之间出现下降趋势。对于案例C ,SD 增加,一直到23.5 ng/mL的浓度,之后稍微降,直至79.3 ng/mL。总體(tǐ)而言,浓度较高校准点的SD大于浓度较低校准点。校准曲線(xiàn)之间的非恒定 SD 模式代表示异方差性,在较高浓度下的高变异性表明需要使用(yòng)加权拟合。图1所示的决策树指明了如何确定适当的权重因子和可(kě)以接受的拟合模型。
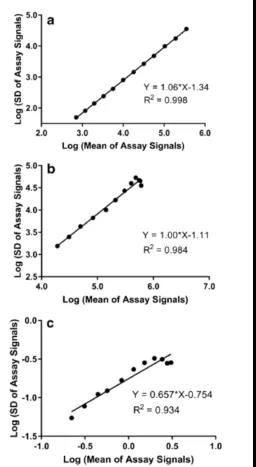
為(wèi)了确定权重因子,首先需要从下面的線(xiàn)性回归中得出斜率(k值):对数变换的测试信号SD vs 对数变的换测试信号平均值(图4);然后,应用(yòng) 1/Y2k 方程式来计算最终的权重函数。对于案例 A,B 和 C,線(xiàn)性回归的斜率分(fēn)别為(wèi) 1.06、1.00 和 0.657。对于案例 A 和 B,由于斜率接近1.0,因此在4PL和5PL模型中使用(yòng)了权重函数1/Y2 。对于 C 例,权重函数為(wèi) 1/Y,由于斜率接近 0.5。在Waston LIMS中,只有(yǒu) 1/Y or 1/Y2这两种权重函数可(kě)用(yòng)。
图4. 案例 A(a)、案例 B (b) 和案例 C (c)中k值的确定。案例 A、B 和 C 的斜率(k值)分(fēn)别為(wèi) 1.06、1.00 和 0.657。案例A、B和C的R2(确定系数coefficient of determination)分(fēn)别為(wèi)0.998、0.984和0.934。
為(wèi)确定可(kě)以接受的曲線(xiàn)拟合模型,考察了如下参数:4PL和 5PL模型;权重函数:1/Y2(案例A),1/Y2(案例B)和 1/Y(案例C);比较参数:回算浓度的累积 %RE(图5)和累积 %CV(图6)。应当选择在可(kě)接受的范围内,具有(yǒu)较低的%CV和%RE校准点数量较多(duō)的回归模型。如果两者都是相当的,则应选取加权4PL作為(wèi)最终的曲線(xiàn)拟合模型。在 Watson LIMS 中生成每次运行的回算浓度。所有(yǒu)情况的回算浓度的累积 %RE和 %CV计算(在曲線(xiàn)拟合模型确定章节的 B 部分(fēn))。图5和图6给出了加权4PL模型与加权5PL模型的累积 %RE和累积 %CV的比较。
如图5所示,对于具有(yǒu)相应权重函数的4PL和5PL模型,所有(yǒu)校准点的 %RE分(fēn)别:案例A, 低于4%和3%;案例 B,低于18%和16%;案例 C,低于7 和 6%。在所有(yǒu)案例研究中,加权4PL和加权5PL模型的准确度是相当的,对于案例 A、B 和 C,所有(yǒu)校准点都在可(kě)以接受的范围内。根据准确度行為(wèi)图推断的定量范围(ROQ)分(fēn)别為(wèi):0.317-178 ng/mL(案例A),0.602-250 ng/mL(案例B),和1.37-79.3 ng/mL(案例C)。
图5. 准确度行為(wèi)图。对案例A(a)、案例B(b)和案例C(c)中校准曲線(xiàn)的加权(1/Y或者1/Y2)拟合模型进行了比较。比较模型:4PL vs 5PL;比较参数:回算浓度的累积相对误差(%RE)。两条虚線(xiàn)之间的區(qū)域是可(kě)接受范围(± 20%)。(○)代表4PL加权拟合,(□)代表5PL加权拟合。
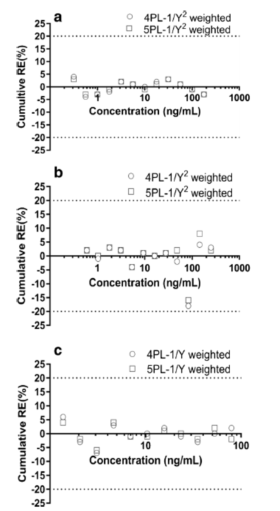
图6显示,对于加权4PL和加权5PL曲線(xiàn)拟合模型,所有(yǒu)校准点的累计%CV:案例A,低于3.0和2.9%;案例B,低于39.7%和26.3%;案例C,低于6.6%和10.8%。案例A和C对两个拟合模型加权拟合后,所有(yǒu)校准点的 %CV变得相当了。对案例A和C,所有(yǒu)校准点的加权4PL和加权5PL的精密度也是相似的。根据精密度行為(wèi)图推断的ROQ分(fēn)别為(wèi)0.317-178 ng/mL(案例A)和1.37-79.3 ng/mL(案例C)。使用(yòng)加权4PL模型,与加权5PL模型相比,案例B可(kě)以接受的校准点数量从9增加到11,加权4PL模型的估算的ROQ 為(wèi) 0.602-145 ng/mL,而加权5PL模型的检测范围较窄:0.602 - 48.3 ng/mL。根据接受标准,对于案例 A、B 和 C ,最终可(kě)以接受的曲線(xiàn)拟合模型都是4PL,权重函数分(fēn)别為(wèi) 1/Y2,1/Y2和1/Y。
图6. 精密度行為(wèi)图:案例A(a),案例B(b)和案例C(c)比较模型:加权4PL vs 加权5PL;比较参数:回算浓度的 %CV。虚線(xiàn)和X轴之间的區(qū)域是可(kě)接受范围(± 20%)。(○)代表 4PL 加权拟合,(□)代表 5PL 加权拟合。
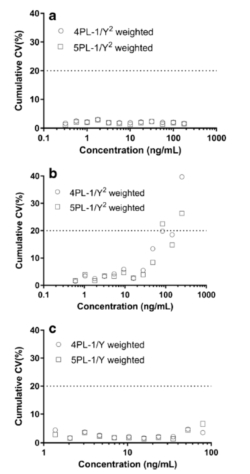
图7演示了对案例 A 应用(yòng)上述方案后,校准曲線(xiàn)性能(néng)是如何改进的(此处不显示案例B和C的图表)。使用(yòng)非加权4PL回归模型回算浓度绘制的准确度行為(wèi)图(累积 %RE,图7a)表明,与加权相比此模型表现出更窄的动态范围,0.563-178 ng/mL;加权4PL模型:0.317-178 ng/mL。非加权 5PL回归模型显示更好的准确度:所有(yǒu)校准点低于20%。但是,在应用(yòng)1/Y2的权重函数(在“异方差度评估”章节确定)后, 所有(yǒu)校准点的累积 %RE得到改善,都在±3%以内(图7a)。
精密度行為(wèi)图(累积 %CV,图7b)显示,非加权4PL和5PL回归模型的ROQ显著狭窄:1.00-178 ng/mL;而在使用(yòng)了1/Y2 的权重函数后,ROQ变為(wèi)0.317-178 ng/mL。该校准曲線(xiàn)低端的效能(néng)的显著改善显示了加权拟合的力量,因其降低了高变异性的测试信号对曲線(xiàn)拟合的影响。案例A表明,使用(yòng)适当的权重函数可(kě)以提高精密度和准确度(均低于4%)以及扩展定量范围(0.317-178 ng/mL)。
图7. 案例A标准曲線(xiàn)加权之前和之后,4PL和5PL模型的准确度和精密度行為(wèi)图。累积 %RE(图 7a)和累计 %CV(图7b)在模型之间的比较:4PL vs. 5PL(无权重);以及4PL vs. 5PL(权重因子:1/Y2)。
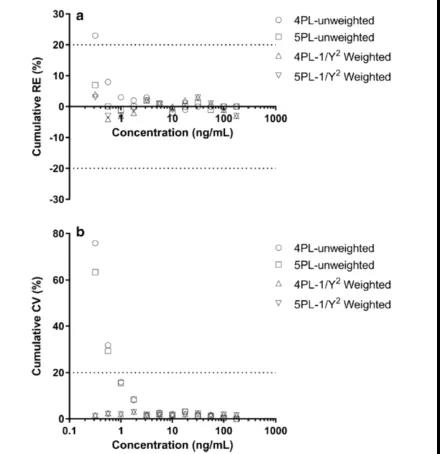
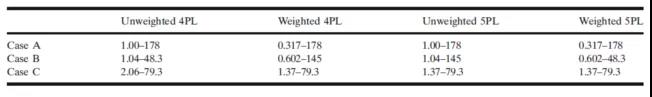
表2显示,使用(yòng)适当的权重函数可(kě)以扩展ROQ。对案例B,应用(yòng)权重函数到4PL回归模型后,ROQ得到显著扩展;从未加权的1.04-48.3 ng/mL到 加权的0.602-145 ng/mL;加权5PL模型的ROQ,则从未加权1.04-145 ng/mL变為(wèi)加权的0.602-48.3 ng/mL。对案例C,4PL模型的ROQ略有(yǒu)扩展:从未加权的2.06-79.3 ng/mL,到加权的1.37-79.3 ng/mL。对于5PL模型,使用(yòng)权重函数后ROQ没有(yǒu)增加。
本文(wén)為(wèi)确定LBA定量分(fēn)析方法中校准曲線(xiàn)的回归模型及权重函数的选择,提供了一个决策树和相应的方法,目的是為(wèi)了為(wèi)减少异方差性(heteroscedasticity)的影响。本文(wén)的建议得到3个案例研究的支持。
由于LBA中平衡结合(equilibrium binding)的特性,实践中经常观察到测试响应的非恒定方差,称為(wèi)异方差性(heteroscedasticity)。本文(wén)发现線(xiàn)性回归斜率方法(linear regression slope approach)是解决异方差性最实际的方法。
在方法开发过程中,可(kě)以绘制校准曲線(xiàn)的测试信号的标准方差(standard deviation,SD)与校准点浓度的对数的相关图。一条校准曲線(xiàn)的非恒定SD趋势表明存在异方差性,这意味着需要使用(yòng)权重函数。所有(yǒu)的3个案例研究(A,B 和 C)都显示,测试信号在较高药物(wù)浓度下,具有(yǒu)更高的变异性,需要加权拟合校准曲線(xiàn)。一般而言,任何一个LBA定量分(fēn)析方法,都会受益于使用(yòng)权重函数。
需要注意的是,一旦确定需要权重因子,如何确定正确的权重因子则成為(wèi)重中之重。本文(wén)推荐的方法是:首先,从测试信号(Y)的标准方差(对数变换后)与测试信号平均值(对数变换后)的線(xiàn)性回归关系中,确定其斜率,又(yòu)称k值;然后,将斜率(k) 代入以下方程 1/Y2k 中,以确定权重因子(1/Y 或 1/Y2)。
在案例研究 A、B、C 中,線(xiàn)性回归的斜率分(fēn)别為(wèi) 1.06,1.00 和 0.657; 因此,权重因子分(fēn)别估计為(wèi)2,2和1。在案例A和B中,权重因子為(wèi)2; 因此,在校准曲線(xiàn)回归模型(4PL或5PL)中,使用(yòng)了权重函数1/Y2。对于案例C,权重系数為(wèi) 1; 因此,权重函数為(wèi) 1/Y。
為(wèi)了确定可(kě)接受的曲線(xiàn)拟合模型,应评估拟合曲線(xiàn)的4PL与5PL模型(不加权和加权)回算浓度的累积 %RE和累积 %CV。应当选择,在可(kě)接受的范围内,具有(yǒu)较低的%CV和%RE,校准点数量较多(duō)的回归模型。如果两者都是相当的,则选择加权4PL模型作為(wèi)最终曲線(xiàn)拟合模型,进行方法验证和样本分(fēn)析。根据 FDA 指南,应当选择假设最少的模型,即选择最简单的模型。根据精密度和准确度数据,在所有(yǒu)3个案例中,4PL都是基于这些标准的最佳回归模型。
為(wèi)了验证所选择回归模型和权重函数,可(kě)以做其他(tā)评估。例如,在使用(yòng)权重函数之前和之后,可(kě)以比较4PL和5PL模型的准确度和精密度行為(wèi)。本文(wén)给出了4PL与5PL(无加权和 1/Y2加权)的累积 %CV 和累积 %RE 的比较,累积 %RE的可(kě)接受范围為(wèi)± 20%,累积 %CV 的可(kě)接受范围為(wèi)≤20%。
案例A表明,使用(yòng)适当的权重函数可(kě)以提高精密度和准确性(均低于10%)和扩展定量范围(0.317-178 ng/mL)。在案例B和C中,校准曲線(xiàn)拟合也有(yǒu)改善。案例B在4PL回归模型上加权后,ROQ得到显著扩展:未加权时為(wèi)1.04-48.3 ng/mL;加权后為(wèi) 0.602-145 ng/mL;5PL模型,未加权1.04-145 ng/mL,加权后0.602-48.3 ng/mL。案例C4PL模型在加权后ROQ 略有(yǒu)扩展:未加权2.06-79.3 ng/mL;加权為(wèi)1.37-79.3 ng/mL。
在定量 LBA 方法开发过程中,本文(wén)介绍了一个简单、易于使用(yòng)的决策树,以确定校准曲線(xiàn)的最佳回归模型和权重。所推荐的方法将选择一个加权的曲線(xiàn)拟合模型。
1. 在方法开发过程中,至少需要使用(yòng)3个独立的测试运行对模型选择进行初步评估; 但是,一般建议增加运行的数量,以便在研究前验证时,验证曲線(xiàn)拟合模型。由于对响应-误差关系的估计存在局限性,因此不建议使用(yòng)较小(xiǎo)的数据集合;
2. 评估异方差性;
3. 如果存在异方差性,就通过斜率方法确k值(即斜率),然后计算权重因子(权重函数=1/Y2k);
4. 使用(yòng)准确度(%RE)和精密度(%CV)行為(wèi)来选择和验证更好的加权回归模型;
5. 建议使用(yòng)独立制备的质量控制样品(QC)来验证分(fēn)析方法的定量范围。
本文(wén)如有(yǒu)疏漏和误读相关指南和数据的地方,请读者评论和指正。所有(yǒu)引用(yòng)的原始信息和资料均来自已经发表學(xué)术期刊, 官方网络报道, 等公开渠道, 不涉及任何保密信息。参考文(wén)献的选择考虑到多(duō)样化但也不可(kě)能(néng)完备。欢迎读者提供有(yǒu)价值的文(wén)献及其评估。