上周,“袁来如此”专栏就LBA定量方法的监管验证展开了第一期详细介绍,围绕历史视角、文(wén)件记录要求、测试试剂的选择、稳定性、测试格式和运行/批次大小(xiǎo)(batch/run size)、参照(比)物(wù)(REFERENCE MATERIAL)特异性(specificity)和选择性(selectivity)等方面的内容进行分(fēn)享,本期将延续上期内容,继续分(fēn)享后续相关内容。
样本基质的选择、样本制备和最低稀释倍数(MINIMUM REQUIRED DILUTION,MRD)选择基质时的考虑因素,是小(xiǎo)分(fēn)子开发的分(fēn)析方法与為(wèi)大分(fēn)子药物(wù)开发LBA定量分(fēn)析方法之间的关键區(qū)别之一。小(xiǎo)分(fēn)子分(fēn)析方法通常包括一个分(fēn)析前的萃取步骤,该样本前处理(lǐ)步骤通常有(yǒu)助于减轻单个基质的变异性所带来的问题。
而蛋白待测物(wù)的固有(yǒu)特性使得在样本分(fēn)析之前做萃取很(hěn)难,通常是完全无法萃取。因此,通常所开发大分(fēn)子定量方法无需萃取,即可(kě)测定复杂生物(wù)基质中的待测物(wù)。然而,在可(kě)能(néng)存在内源性蛋白待测物(wù)的情况下,必须仔细地考虑基质的选择和数据分(fēn)析。
方法开发阶段
所收集的生物(wù)样品中的待测物(wù)存在于不同的基质中,包括血浆、血清、尿液、脑脊液(CSF)、关节滑液和均质化的组织。由于待测物(wù)的特性会受到样本制备方法影响,因此必须在样本采集过程中评估如下因素:所需要的任何添加剂(抗凝剂、蛋白酶抑制剂等)、待测物(wù)的稳定性(血浆或血清分(fēn)离前的全血)、样本收集后的处理(lǐ)和储存条件(温度、瓶型等)。测试格式、样本收集条件和其他(tā)因素可(kě)能(néng)会影响基质的选择,例如如果使用(yòng)自动化样本处理(lǐ)系统,则血清将是首选的基质,因為(wèi)血浆中通常含有(yǒu)血纤维蛋白凝块,可(kě)能(néng)会干扰移液操作。相比之下,血浆是不稳定待测物(wù)的首选基质,因為(wèi)制备血清所需的时间较長(cháng),而且存在蛋白水解酶(proteolytic enzyme)降解蛋白的问题。本文(wén)稍后将对样本收集后基质中的待测物(wù)进行更确切的稳定性评估。加标样品(spiked sample)的基质应当与预期的未知研究样本的基质相同,要使用(yòng)相同的基质制备标准品(标/校准品,standard/calibrator)。当在基质中检测不到内源性信号时,简单地加标/回收研究就足以确定合适的空白基质。在这些条件下,建议使用(yòng)标称浓度(nominal concentration)。相反,当基质中存在可(kě)定量的内源性物(wù)质,并且内源性物(wù)质和外加待测物(wù)的回收率是累加式(線(xiàn)性)的时候,可(kě)以应用(yòng)一个校正因子(例如内源性浓度4ng/mL,加标分(fēn)析物(wù)為(wèi)6ng/mL,累加效应為(wèi)10ng/mL)。在这种情况下,可(kě)将所测定的内源性浓度与所添加的待测物(wù)浓度(标称值)相加来得到指定值(assigned value)(表IIA和表IIB)。表IIA.内源性蛋白累加贡献效应的示例。在这种情况下,内源性蛋白的影响可(kě)以在低质量对照样品(QC)中观察到;但其对中、高水平质量对照样品的影响不大。
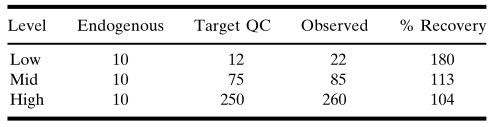
表IIB. 当等體(tǐ)积的基质和QC加在一起时,内源性蛋白累加(線(xiàn)性)贡献的示例。方法:50mL含内源性药物(wù)的基质(25.7U/L)+ 50mL 标准品10(10U/L)= 期望值17.9U/L(相互以1:2的比例稀释:12.85U/L+ 5U/L= 17.85U/L)
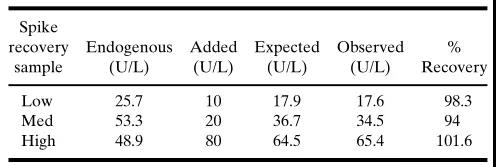
另一种选择是减去内源性浓度,该浓度是用(yòng)正在验证的分(fēn)析方法或一个正交的(orthogonal)分(fēn)析方法所测定的。这种方法需要分(fēn)析空白样品(另外加待测物(wù)),这样就可(kě)以减去内源量,并计算出外加的标称量。当内源性浓度和外加的待测物(wù)浓度不是線(xiàn)性关系时,就不能(néng)用(yòng)数學(xué)方法将这两个浓度相加,因而只能(néng)报告测定的(观察到的)浓度(表IIC)。或者可(kě)以在外加待测物(wù)之前,剥离空白基质中内源性蛋白。
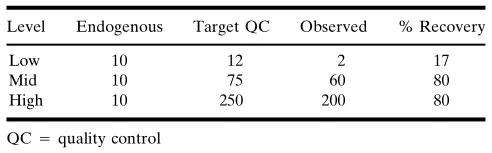
表IIC. 内源性蛋白非線(xiàn)性贡献的例子。观察到的药物(wù)浓度与“空白”基质中的内源药物(wù)量或外加的“目标”浓度均不是線(xiàn)性相关。在这种情况下,观察到(测定)的浓度是唯一可(kě)以放心使用(yòng)的数值。
通常不推荐使用(yòng)剥离了内源物(wù)的基质或替代基质,但在无法设计其它策略来定量内源物(wù)时,则是必要的。使用(yòng)木(mù)碳(charcoal)剥离的基质,很(hěn)难保证基质的其它方面不发生变化。如果使用(yòng)配體(tǐ)亲和层析剥离内源物(wù),配體(tǐ)的溶出可(kě)能(néng)会干扰该分(fēn)析方法。无论基质干扰的来源如何,制备QC样品时,必须使用(yòng)与研究样本类型一致的、纯粹且未改变的基质。除了保证待测物(wù)的稳定性外,在纯粹基质(neat matrix)中制备QC样品还可(kě)用(yòng)于同时测定分(fēn)析方法的精密度和准确性。
当难以获得生物(wù)基质(例如关节滑液、脑脊液)时,可(kě)以用(yòng)一个替代基质(substitute matrix)来制备标准曲線(xiàn)。应尝试使用(yòng)真实样本基质制备至少一个级别的QC样品,以证实基质效应没有(yǒu)影响准确度,即没有(yǒu)均值偏差(mean bias)。分(fēn)析方法所需的最小(xiǎo)稀释倍数(MRD)是必须稀释样本的最小(xiǎo)稀释倍数,是為(wèi)了在分(fēn)析时使用(yòng)规定的标准品和样本稀释液,以达到最优的准确度和精密度。在某些情况下,如当标准品是在100%的血清或血浆中制备时,则不存在MRD,可(kě)以直接分(fēn)析未稀释的纯粹样本。在其它情况下,如果内源性物(wù)质没有(yǒu)产生線(xiàn)性信号或观察到的背景信号不是由于内源性的分(fēn)析物(wù)(例如,heterophilic antibodies,风湿因子)增加影响的,则可(kě)能(néng)需要稀释样本,以建立可(kě)接受的線(xiàn)性关系。為(wèi)了克服信噪比的问题,所有(yǒu)的样本都必须以某个倍数进行最低限度的稀释,以取得更高的重现性和准确度。研究前验证阶段
在方法开发过程中所选择的生物(wù)基质将用(yòng)于制备研究前验证所用(yòng)的标准品和验证样品。一旦在方法开发过程中解决了基质的影响,就不需要进一步的验证,但验证报告中应该包括对该解决方法的讨论。如果使用(yòng)的是经过剥离的基质,验证样品则必须在同样的基质中制备,以评估精密度和准确性。在方法开发过程中选择的MRD也将在研究前验证中得到确认。研究中验证阶段
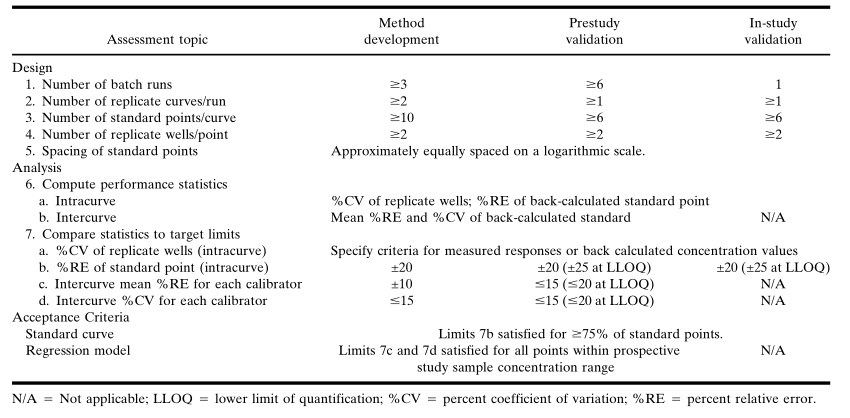
在研究中验证时,除了在观察到基质干扰时需要额外稀释样本外,没有(yǒu)与样本制备相关的接受标准。由于潜在的基质干扰而导致重新(xīn)分(fēn)析样品时,应当预先设定并常规地应用(yòng)相关指导原则。在基质批次变化的情况下,应当制备相同浓度的QC样品,证实与研究前验证数据的可(kě)比性,然后继续进行样本分(fēn)析。标准校准物(wù)(STANDARD CALIBARTOR)和标准曲線(xiàn)将已知数量表征良好的标准参照(比)物(wù)(待测物(wù),analyte)加入到适当的基质中制备标准校准品,在既定的分(fēn)析条件下生成并得到浓度-响应关系,即标(校)准曲線(xiàn)(standard curve)。根据这个标(校)准曲線(xiàn),未知样品中分(fēn)析物(wù)的浓度可(kě)以通过内插方法计算。在方法开发过程中,应当建立标准品的浓度和将一条曲線(xiàn)拟合于校准数据的回归模型,此模型需在研究前验证期间得到确认,并在分(fēn)析研究样本时使用(yòng)。表III汇总了评估标准曲線(xiàn)数据设计和分(fēn)析回归模型的建议,将使用(yòng)表IV中的研究前验证的标准曲線(xiàn)数据说明统计分(fēn)析的过程。表III. 标准曲線(xiàn)评定标准. (未包括“锚定点”)
表IV.一个研究前验证的标准曲線(xiàn)响应值
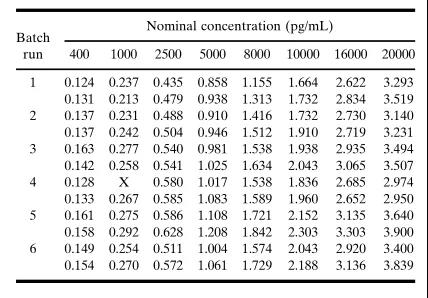
方法开发阶段
由于标准点浓度在方法验证开始后不应改变,因此在方法开发过程中应包括更多(duō)的标准点(standard point)和重复点(replicates),以便尽早地详细研究浓度-响应关系,尽可(kě)能(néng)地实现為(wèi)回归模型提供可(kě)靠的评估。标准参照(比)物(wù)浓度点的范围应包括稀释后研究样品的浓度,并在对数刻度上近似均匀地间隔。建议至少有(yǒu)10个非零标准浓度点(复孔,duplicate)用(yòng)于浓度-响应关系,用(yòng)于其早期特征的描述。该浓度-响应关系可(kě)以使用(yòng)4/5参数的logistic函数(4/5PL 模型)来描述。标准曲線(xiàn)应拟合校准浓度点的平均响应值(图1A)。图1. A.5参数logistic (5PL)加权非線(xiàn)性最小(xiǎo)二乘法回归拟合的曲線(xiàn)。平均响应是表IV.中列出了第6个运行(batch)的重复结果。B.图1A中回算标准点浓度的百分(fēn)比相对误差。所有(yǒu)数值都在标称值的10%以内。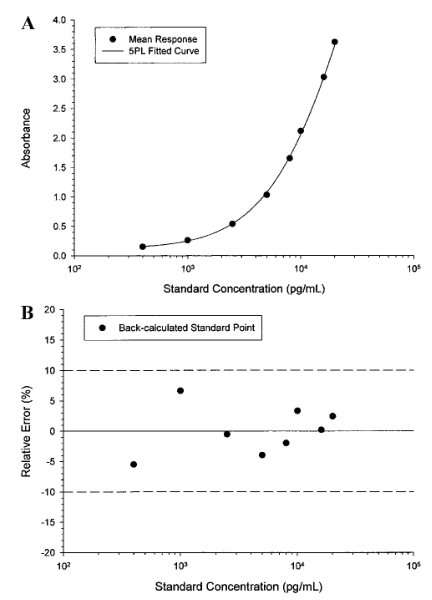
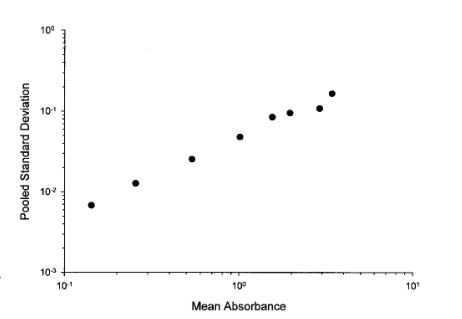
拟合曲線(xiàn)时,对平均响应值是否加权的问题,应通过对复孔数值的标准方差与不同浓度点的平均值之间的关系来评估决定。例如,表IV中标准校准点浓度的混合标准方差与平均响应的关系图在对数刻度上显示了一个線(xiàn)性增加的关系(图2)。在这种情况下,加权拟合通常比不加权更合适。在考虑删除复孔值的标准时,有(yǒu)关复孔值变异性的信息会非常有(yǒu)用(yòng)。
表IV.一个研究前验证的标准曲線(xiàn)响应值
图2. 表IV所列标准曲線(xiàn)吸光度值的混合运行(batch)内标准方差与累积平均响应之间的关系。每个点代表一个浓度点的平均值和通过方差分(fēn)析(ANOVA)计算的标准方差。在高吸光度水平下,变异性较大;这表明,在拟合标准曲線(xiàn)时,加权可(kě)能(néng)是适当的。
在建立校准模型时,建议分(fēn)析至少3个独立运行(batch/run)的标准曲線(xiàn)浓度-响应数据,每次运行应包含两条标准曲線(xiàn),以便评估运行内标准曲線(xiàn)的可(kě)重复性。模型的适宜性取决于标准点回算浓度的RE,计算一个浓度点的RE如下:从回算浓度中减去标称浓度并将其差值除以标称浓度。通常,对于曲線(xiàn)内的大多(duō)数标准点回算浓度的绝对RE应為(wèi)20%。例如,根据加权5PL回归曲線(xiàn)拟合平均光吸收值(表IV中第6个运行的数据)所得出的模型,回算浓度的绝对REs都是<10%(表V和图1B)。同样,其他(tā)5个运行的绝对REs也始终一致地<10%(第1个运行中的几个点除外)。
表 V. 对于表IV中数据的平均响应,回算的标准浓度的百分(fēn)比相对误差 (%RE)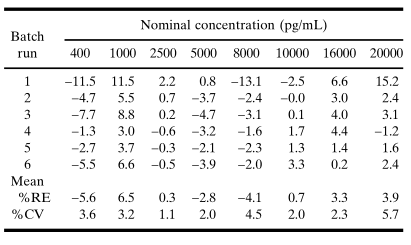

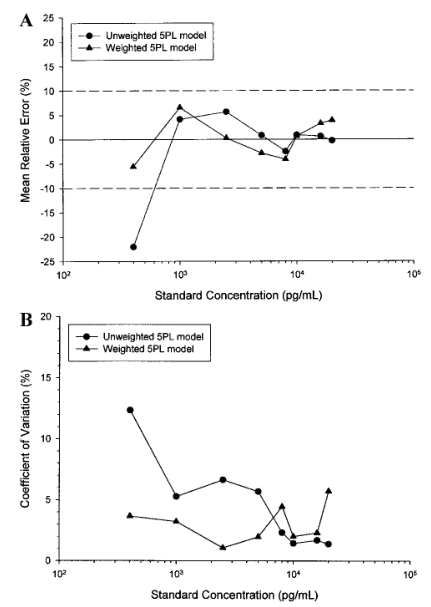
一个可(kě)被接受的校准模型,其曲線(xiàn)的累积回算数值对于在预期的定量范围内的所有(yǒu)浓度,应具有(yǒu)10%的绝对平均RE值和15%的变异系数(CV)(参见表V)。在校准品浓度范围中,如果平均RE存在一个趋势,即回算浓度始终一致地高于或低于标称浓度,则是拟合失败的证据,会使该模型失效。拟合失败可(kě)能(néng)是由于选择了不合适的平均值函数(例如,在浓度-响应曲線(xiàn)不对称时使用(yòng)了4PL函数)或加权过程不当。例如,加权使得拟合的曲線(xiàn)与表IV中的数据更相符,其证据是:在较低浓度部分(fēn),降低了平均RE(图3A)和CV(图3B);而在较高浓度部分(fēn),准确性或精密度的损失极小(xiǎo)。图3. A.未加权和加权五参数logistic(5PL)回归曲線(xiàn)回算浓度的累积平均相对误差百分(fēn)比的比较与表IV的吸光度数据相吻合。加权模型的结果在整个标准浓度范围是可(kě)以接受的,而非加权模型在低于1000pg/mL浓度是不可(kě)接受的。B.未加权和加权五参数logistic (5PL)回归曲線(xiàn)回算浓度变化的累积百分(fēn)比系数的比较与表IV的吸光度数据相吻合。加权回归模型的计算值总结如下在表V中。加权模型在较低浓度水平下得到了较小(xiǎo)的批间变化系数。
表IV.一个研究前验证的标准曲線(xiàn)响应值

表 V. 对于表IV中数据的平均响应,回算的标准浓度的百分(fēn)比相对误差 (%RE)

研究前验证阶段
对研究前验证所需的标准校准品,应根据方法开发过程中获得的性能(néng)信息来制备。通常,对于使用(yòng)4/5PL函数来拟合的浓度-响应关系,在预期的浓度范围内,应至少包括6个非零、复孔校准点,这些校准点应在对数刻度上近似均匀地间隔。為(wèi)了改善曲線(xiàn)拟合,可(kě)以包括定量范围之外的锚定点或校准点。
在方法开发过程中建立的回归模型应在至少6个独立的研究前验证运行中得到确认,通常也在相同的运行中评估方法的精密度和准确度。在一个运行中接受标准曲線(xiàn)时,回算浓度值(至少為(wèi)75%,不包括锚定点和校准点)的%RE应在标称浓度的20% 以内(对于LLOQ,%RE应在25%以内)。验证结束时,应為(wèi)每个校准点计算所有(yǒu)运行的累计平均%RE和%CV,如果每一个标准点(不包括锚定点)的RE和CV均為(wèi)15%,则回归模型是可(kě)以接受的;在LLOQ,%RE和%CV应為(wèi)20%。应当在报告验证样品的分(fēn)析结果之前确认回归模型。由于可(kě)确定的原因造成了技术误差(如,移液误差),或可(kě)通过应用(yòng)a priori统计标准编辑标准曲線(xiàn),屏蔽某些校准点。
研究中验证阶段
对每个研究中的测试运行,应使用(yòng)与研究前验证相同的标准,监测标准曲線(xiàn)和编辑标准曲線(xiàn)中某个校准点。标准曲線(xiàn)的编辑必须独立于QC,并于评估QC样品的性能(néng)之前完成。编辑后剩余的校准点的最终数量必须≥总校准点的75%;或者除锚定点外,至少有(yǒu)6个校准点。如果删除高(ULOQ)或低校准点(LLOQ)中的任何一个,这个运行的定量范围将被限制在下一个校准点,所以,必须重新(xīn)分(fēn)析超出定量范围的样本。本文(wén)如有(yǒu)疏漏和误读相关指南和数据的地方,请读者评论和指正。所有(yǒu)引用(yòng)的原始信息和资料均来自已经发表學(xué)术期刊、官方网络报道等公开渠道, 不涉及任何保密信息。参考文(wén)献的选择考虑到多(duō)样化但也不可(kě)能(néng)完备,欢迎读者提供有(yǒu)价值的文(wén)献及其评估。










































