

























随着國(guó)家鼓励新(xīn)药研发、药品审评审批制度改革的快速推进,化药注册分(fēn)类、上市许可(kě)持有(yǒu)人制度等重磅政策的陆续出台,我國(guó)新(xīn)药研发迎来暖春。对于力图在创新(xīn)药领域深耕的从业者而言,如何洞悉全局,乘势而為(wèi),或将成為(wèi)未来成败的关键。
為(wèi)此,广州博济医药微信公众号特邀生物(wù)分(fēn)析专家、博济医药子公司深圳博瑞副总经理(lǐ)袁智博士,开设“袁来如此”专栏,就大分(fēn)子生物(wù)分(fēn)析、药代动力學(xué)等相关话题展开专题研究,希望通过相关知识与经验的分(fēn)享,引发更多(duō)读者的讨论交流,加速振兴中國(guó)的生物(wù)医药产业发展,敬请垂注!
本文(wén)為(wèi)“袁来如此”专栏的第一篇,旨在根据已发表的文(wén)献资料,对与大分(fēn)子生物(wù)分(fēn)析相关的知识进行系统地介绍。
配體(tǐ)结合式测试方法(LBA,也称為(wèi)immunoassays)是一种常用(yòng)的分(fēn)析工具,用(yòng)于根据与其他(tā)生物(wù)分(fēn)子的相互结合作用(yòng)(binding interaction),定量测定生物(wù)分(fēn)子(目标分(fēn)析物(wù),Analyte)在生物(wù)體(tǐ)液中的浓度。LBA要求至少使用(yòng)一个生物(wù)分(fēn)子来定量目标分(fēn)析物(wù),这个生物(wù)分(fēn)子通常被称為(wèi)关键试剂,须能(néng)够特异性地结合目标分(fēn)析物(wù)。
LBA可(kě)分(fēn)為(wèi)两大类:(1)液相结合测试,其目标分(fēn)析物(wù)与标记过的检测试剂之间的结合反应发生在溶液相(图1A);(2)固相结合测试,其中一个关键试剂被固定到固體(tǐ)表面,如微孔板或树脂(图1B),以捕获样本中的目标分(fēn)析物(wù)。液相测试通常需要分(fēn)离步骤,如色谱或電(diàn)泳或离心,从而将目标分(fēn)析物(wù)-标记检测试剂从未结合的分(fēn)子中分(fēn)离出来进行定量。
在应用(yòng)上,LBA是重要的评估生物(wù)药PK/TK时的主要定量分(fēn)析方法之一,该方法的特异性和选择性取决于目标分(fēn)析物(wù)与其他(tā)生物(wù)分(fēn)子(如受體(tǐ)、针对候选生物(wù)药的抗體(tǐ)和核酸适配體(tǐ)(aptamer))的相互作用(yòng)。
该方法中可(kě)观察到仪器响应与生物(wù)药的浓度间接相关,简言之,检测信号的来源是酶化學(xué)反应或放射化學(xué)反应,而这些反应则是各种相互结合作用(yòng)(binding interactions)的一部分(fēn)。
一般而言,大分(fēn)子的物(wù)理(lǐ)化學(xué)特性无法直接产生检测信号,不能(néng)用(yòng)于这样的定量分(fēn)析方法。主要原因在于这些binding interactions的内在性质,LBA的标(校)准曲線(xiàn)的动态(定量)范围比较狭窄,同时也是非線(xiàn)性,S型的(sigmoidal curve)。
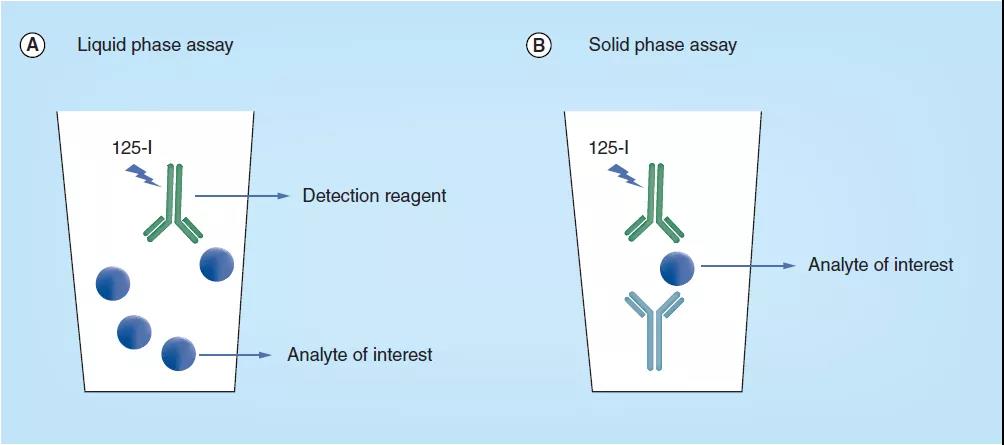
如图1所示,在液相测试中,结合反应在溶液中发生,其中一个目标分(fēn)析物(wù)与标记过的检测试剂结合,然后再通过后续的分(fēn)离操作将目标分(fēn)析物(wù)-标记检测试剂从未结合的分(fēn)子中分(fēn)离出来。
在固相测试中,一个关键试剂被固定到固體(tǐ)表面,如微孔板或树脂,此试剂在固體(tǐ)表面结合目标分(fēn)析物(wù),从而致使未结合的分(fēn)子被分(fēn)离出来。
Yalow和 Benson于1960年开发的测定人类胰岛素的方法,是放射免疫测定(RIA)的标志(zhì)性例子,Yalow因此于1977年获得诺贝尔奖。简单地说,就是通过用(yòng)鱼精蛋白锌牛胰岛素或商(shāng)业常规牛胰岛素免疫豚鼠,以获得作為(wèi)该RIA方法关键试剂的胰岛素结合抗體(tǐ)。
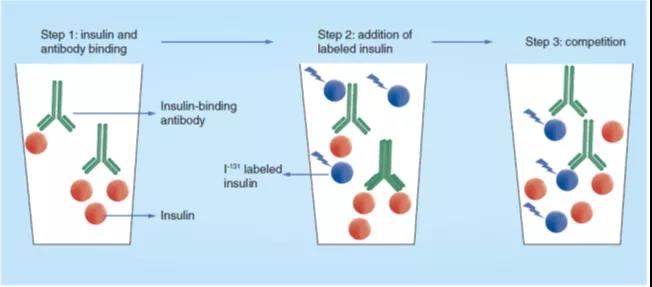
在这种方法中,由于缺乏人类胰岛素的结晶體(tǐ),因此I131标记的结晶牛胰岛素(胰岛素-I131)被用(yòng)作示踪剂。此 RIA 的原理(lǐ)是基于样本中的人胰岛素与豚鼠血清中的胰岛素结合抗體(tǐ)的强力结合(图2中的步骤1),并让已知浓度的胰岛素-I131与该抗體(tǐ)的结合竞争(图2步骤2-3)。胰岛素-I131与胰岛素结合抗體(tǐ)的结合在溶液中进行,游离的胰岛素-I131与结合了抗體(tǐ)的胰岛素-I131的分(fēn)离通过纸色谱電(diàn)泳技术实现,这就使得定量测定胰岛素-I131成為(wèi)可(kě)能(néng),其代表了样本中胰岛素的浓度。在此方法中,最低可(kě)定量的胰岛素浓度為(wèi)1.4μU。
在这个有(yǒu)里程碑意义的研究发表之后,RIA在20世纪后期得到了广泛的应用(yòng)。在使用(yòng)适当的关键试剂时,RIA灵敏度和选择性都极高,而其主要挑战包括使用(yòng)和处置放射性材料的许可(kě)证要求、放射性同位素的标记效率、成本及其有(yǒu)限的半衰期。在RIA得到应用(yòng)的十年内,即20世纪的70年代初,就出现了非同位素免疫测定,如酶免疫测定(enzyme immunoassays,EIA),EIA通常被称為(wèi)ELISA,即酶联免疫吸附试验(enzyme linked immunosorbent assay)。
Engvall和Perlmann在1971年首次描述了一个定量兔免疫球蛋白G(兔IgG)的ELISA方法。其实质就是从羊血清中提取的抗兔IgG用(yòng)于结合兔子IgG,进而结合了一种碱性磷酸酶(ALP)的兔IgG被用(yòng)来与兔IgG相互竞争和抗兔IgG血清的结合,以此建立浓度与仪器响应(信号)之间的关系,生成的仪器信号与样本中的IgG量成反比。随着技术的不断发展,學(xué)界运用(yòng)了不同的酶,如辣根过氧化物(wù)酶(HRP)、β-半乳糖苷酶(GAL)和荧光素酶(luciferase),使得EIA具有(yǒu)与RIA相当的灵敏度。

图 2. Yalow最初发明的胰岛素放射免疫测定的原理(lǐ)图。样本中的胰岛素在溶液中与抗胰岛素血清结合(步骤1),然后把已知浓度的I131标记的牛胰岛素添加到反应溶液中(步骤2),样本中的胰岛素与I131标记的牛胰岛素(步骤3)相互竞争与抗體(tǐ)的结合。使用(yòng)人胰岛素制备的标准曲線(xiàn)以及胰岛素抗體(tǐ)结合的I131标记牛胰岛素的浓度可(kě)以计算样本中被置换的胰岛素的浓度。
竞争式ELISA格式是基于初始的胰岛素RIA和IgG EIA方法中的结合竞争。来自样品的目标分(fēn)析物(wù)(analyte)和参照分(fēn)析物(wù)(reference analyte)与分(fēn)析物(wù)特异性的抗體(tǐ)结合之间的竞争是这种格式的关键。
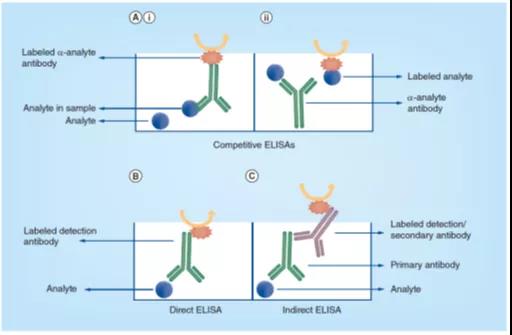
抗體(tǐ)或目标分(fēn)析物(wù)都可(kě)以标记酶,并用(yòng)于结合反应。使用(yòng)标记抗體(tǐ)(图3Ai)时,参照分(fēn)析物(wù)首先被动地吸附到微孔板的孔中,然后加入含有(yǒu)目标分(fēn)析物(wù)的样本,如细胞裂解液、血清等,并与固定浓度的标记抗體(tǐ)一起孵育。样本中的目标分(fēn)析物(wù)与固定的分(fēn)析物(wù)竞争,以结合有(yǒu)限数量的标记抗體(tǐ),随后的酶反应产生的信号与样本中目标分(fēn)析物(wù)的浓度成反比。或者,可(kě)以使用(yòng)固相吸附的抗體(tǐ)和标记分(fēn)析物(wù)(图3Aii),样本中的目标分(fēn)析物(wù)与固定数量的标记分(fēn)析物(wù)共同孵育,并与之相互竞争和固定抗體(tǐ)的结合。与前面的示例中一样,生成的信号与样本中目标分(fēn)析物(wù)的浓度成反比。
直接式ELISA是最简单的ELISA格式,样品中的目标分(fēn)析物(wù)吸附到微孔板的孔中,通过酶偶联试剂或标记检测抗體(tǐ),直接实现目标分(fēn)析物(wù)的检测,如图3B所示。

图3. 竞争式(Ai & Aii)、直接(B)和间接(C)ELISA测试格式的原理(lǐ)图。目标分(fēn)析物(wù)(Analyte)代表被测定的目标蛋白质。在竞争式ELISA中,可(kě)以标记目标分(fēn)析物(wù)或抗體(tǐ),而在直接或间接ELISA格式中,只标记检测抗體(tǐ)。
间接ELISA类似于直接ELISA,两者间主要差别在于主要(primary)抗體(tǐ)未被标记。目标分(fēn)析物(wù)的检测是通过再次添加一个酶偶联试剂或标记检测抗體(tǐ),使其与主要抗體(tǐ)结合而实现的,如图3C 所示。
直接ELISA更快速,因為(wèi)它比间接ELISA少一个步骤。它通常用(yòng)于需要快速完成的常规测试,商(shāng)业化的家用(yòng)怀孕测试就是这种格式的一个例子。而间接ELISA虽然较直接ELISA多(duō)一个步骤,但信号放大通常优于直接ELISA。因此,间接ELISA通常比直接ELISA更敏感,可(kě)以测量更低丰度的蛋白质。
正如图3C 所示,间接ELISA较直接ELISA增加的步骤正是来自于样本的目标分(fēn)析物(wù)直接吸附到微孔板,但想要达到这样的效果,亦有(yǒu)一定的难度。因為(wèi)在洗板步骤中,可(kě)能(néng)会洗掉目标分(fēn)析物(wù),因此可(kě)能(néng)会增加测试的变异性。此外,非特异性地结合到微孔板的其它蛋白可(kě)能(néng)导致假阳性结果。為(wèi)了克服上述挑战,其它可(kě)靠性更高的格式进而衍生出来,其中有(yǒu)通常被称為(wèi)夹心、桥联或竞争性ELISA(在夹心或桥联ELISA格式中),在这些格式中,一种能(néng)与目标分(fēn)析物(wù)特异性结合的生物(wù)试剂首先被吸附到微孔板中。
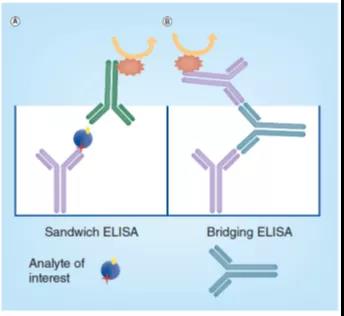
图4. 夹心式ELISA(A)和桥接式(B)ELISA的原理(lǐ)图
夹心式ELISA需要两个不同的试剂或抗體(tǐ),一个用(yòng)于捕获,另一个用(yòng)于检测目标分(fēn)析物(wù)。这些试剂与目标分(fēn)析物(wù)的不同表位(epitopes,结合位点)结合,从而形成夹心式格式(图4A),由此产生的相互作用(yòng)具有(yǒu)特别高的特异性(因為(wèi)捕获和检测步骤都需要特异的表位识别,才能(néng)生成检测信号)。
桥联ELISA常用(yòng)于测定具有(yǒu)两个相同抗原结合位点(2价)的抗體(tǐ)或其它目标分(fēn)析物(wù)的浓度,可(kě)以标记与捕获相同的试剂,用(yòng)于检测一个二价的目标分(fēn)析物(wù),因此,目标分(fēn)析物(wù)可(kě)被视為(wèi)捕获和检测试剂之间的桥梁(图 4B)。夹心或桥接ELISA 格式均可(kě)设计成為(wèi)竞争式的ELISA。
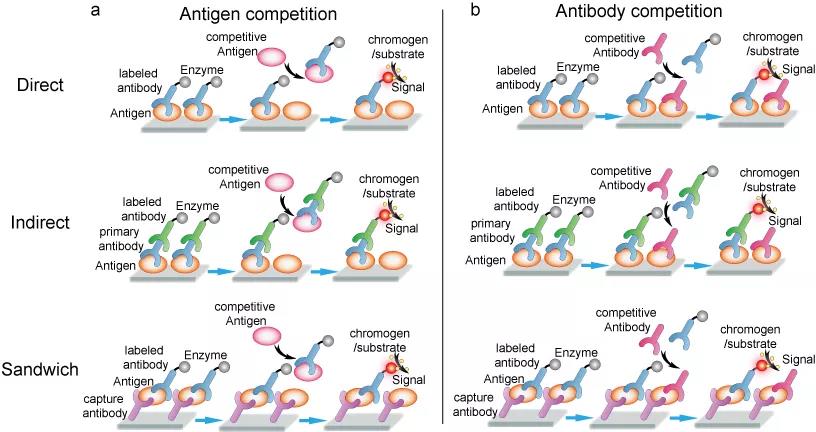
上述格式是ELISA的基本设计,所有(yǒu)格式都可(kě)以使用(yòng)竞争或抑制条件加以调整,来测定抗原或抗體(tǐ)(图5),所有(yǒu)方法都要求与试剂预先反应/孵育才能(néng)达到最佳状态。这些最佳状态可(kě)以通过添加抗原(图5a)或抗體(tǐ)(图5b)来给予挑战。随着溶液中游离的抗原(抗體(tǐ))的增加,能(néng)够与固定底物(wù)(immobilized substrate)结合的抗體(tǐ)(抗原)的数量则减少。洗涤步骤后,添加生色剂底物(wù)(chromophore substrate)以产生信号(颜色变化或发光)。抗體(tǐ)/抗原挑战引起的信号变化揭示了有(yǒu)关竞争性抗原/抗體(tǐ)的信息。竞争式ELISA对于测定复杂混合物(wù)中的抗原浓度相当有(yǒu)用(yòng),特别是在可(kě)能(néng)含有(yǒu)抗原的未知样品与含有(yǒu)已知数量的纯化抗原的类似样品时。
免疫表位(epitope)是宿主免疫系统一般能(néng)够识别的抗原分(fēn)子的一部分(fēn)。当抗原的表位以非共价键的形式与其所诱导产生的抗體(tǐ)的确定互补性的區(qū)域(complementarity determining region)相互作用(yòng)时,就会发生特异性的识别。
抗體(tǐ)亲和力(affinity)表示抗體(tǐ)与其单一目标分(fēn)析物(wù)(analyte)/抗原(antigen)结合的烈度(intensity)或强度(strength),由解离常数(Kd)代表。低亲和力抗體(tǐ)与抗原结合弱,容易解离;而高亲和力抗體(tǐ)与抗原结合非常强,在多(duō)次的洗涤步骤中不易解离。从ELISA的角度来看,后者是首选,通常用(yòng)于捕获目标分(fēn)析物(wù)。
亲和度(Avidity)是衡量一个抗體(tǐ)与多(duō)个抗原决定因子(antigenic determinants)结合的整體(tǐ)强度的指标。抗體(tǐ)对某一个结合位点的亲和力并不总是能(néng)反映抗體(tǐ)-抗原相互作用(yòng)的强度,例如免疫球蛋白G(IgG)有(yǒu)两个抗原结合位点(2价),而IgM有(yǒu)10个抗原结合位点(10价),亲和度表示IgG或IgM的,分(fēn)别对于2个或10个抗原分(fēn)子的整體(tǐ)结合强度(overall strength)。
关键试剂
一个ELISA方法最重要的组成部分(fēn)是测试试剂,它决定了ELISA方法的灵敏度、特异性和方法的质量。ELISAs常用(yòng)于药物(wù)开发:在PK评估中,定量测定蛋白生物(wù)药的浓度;测定内源性蛋白和生物(wù)标志(zhì)物(wù);检测抗药物(wù)抗體(tǐ)的存在以进行免疫原性评估等。LBA方法首选的关键试剂是单克隆抗體(tǐ)(MAbs)或多(duō)克隆抗體(tǐ)(PAbs),而不是重组靶标蛋白。為(wèi)了产生PAbs或MAbs,需要将生物(wù)药或生物(wù)标志(zhì)物(wù)蛋白及其佐剂或载體(tǐ),根据相关应用(yòng)给到合适的宿主动物(wù)物(wù)种上进行免疫。对于PAbs,兔子、山(shān)羊和绵羊是最常用(yòng)的宿主物(wù)种,因為(wèi)它们的體(tǐ)型大(产生的抗體(tǐ)量也大),容易找到血管和强健的免疫反应。
用(yòng)于免疫的每一个抗原都是高度复杂的,因為(wèi)它可(kě)以呈现大量的,可(kě)以被不同的淋巴细胞识别的表位,这些淋巴细胞随后被激活。激活了的淋巴细胞增殖,分(fēn)化成浆细胞,并分(fēn)泌出多(duō)克隆抗體(tǐ)的混合體(tǐ)。PAb库(混合體(tǐ))代表了不同抗體(tǐ)的集合群體(tǐ),这些抗體(tǐ)可(kě)以识别抗原的多(duō)个表位(用(yòng)于ELISA分(fēn)析)。為(wèi)了生产MAbs,需要进一步分(fēn)离单个淋巴细胞,并与骨髓瘤细胞融合,以产生不死的杂交瘤细胞,从而持续产生特定的MAb。因此,同一个克隆(clone)的抗體(tǐ)只识别一个抗原的单个表位。在ELISA中会频繁使用(yòng)MAbs或PAbs,其选择(对于每种ELISA格式而言)取决于许多(duō)考虑因素:如可(kě)及性(Availability)、亲和力、特异性(Specificity)和交叉反应性(Cross-reactivity)。
抗體(tǐ)的特异性(specificity)是特异性地结合相关抗原的能(néng)力,与ELISA方法的选择性(selectivity)不尽相同,但相关。选择性是一个定量分(fēn)析方法,在其它潜在干扰成分(fēn)存在的情况下,从众多(duō)其它无关的蛋白质中鉴别和定量测定目标分(fēn)析物(wù)浓度的能(néng)力。交叉反应性(cross-reactivity)是指抗體(tǐ)与除目标抗原之外的其它多(duō)个抗原结合的能(néng)力。当抗原(目标分(fēn)析物(wù))的与抗體(tǐ)试剂结合的表位与其它蛋白质相似时就会发生交叉反应。一般来说,特异性和交叉反应性对ELISA方法的选择性和基质效应有(yǒu)很(hěn)大影响。如果使用(yòng)高亲和力抗體(tǐ)作為(wèi)捕获试剂,抗體(tǐ)/目标分(fēn)析物(wù)的复合物(wù)就能(néng)够在含有(yǒu)多(duō)种蛋白质的“混合物(wù)”样品中有(yǒu)效地形成,基质效应会随之降低,而方法的选择性最终会得到提升。
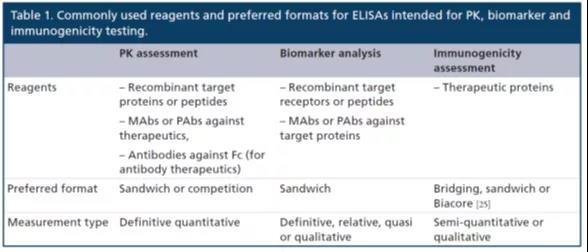
表1总结了ELISA可(kě)能(néng)用(yòng)到的试剂和各种通用(yòng)或首选格式。
测试试剂的可(kě)及性可(kě)能(néng)因药物(wù)开发的不同阶段而异。在早期探索阶段,可(kě)能(néng)无法得到MAbs或PAbs,故常常选择重组生产的配體(tǐ)(即生物(wù)药的靶点)作為(wèi)关键试剂来测定游离的蛋白生物(wù)药(therapeutic protein,TP)的浓度。在早期临床前研究中,针对IgG Fc部分(fēn)的通用(yòng)抗體(tǐ)可(kě)用(yòng)于单克隆抗體(tǐ)药物(wù),尽管仅能(néng)测定总浓度(结合靶标后的TP +游离的TPf)。
生物(wù)标志(zhì)物(wù)的定量分(fēn)析方法
各种體(tǐ)外诊断试剂盒在商(shāng)业上可(kě)用(yòng)于药物(wù)的早期发现阶段,也可(kě)从不同的供应商(shāng)获得各种重组蛋白和抗生物(wù)标记物(wù)蛋白的抗體(tǐ)。虽然生物(wù)标记物(wù)的定量分(fēn)析方法与PK方法相似,但这二者之间存在明显差别。与PK方法类似,生物(wù)标志(zhì)物(wù)的定量分(fēn)析方法可(kě)用(yòng)于测定目标基质中生物(wù)标志(zhì)物(wù)蛋白的游离浓度或总浓度。夹心式测试格式是主要选择,通常用(yòng)于测定生物(wù)标志(zhì)物(wù)蛋白的游离或总浓度。虽然当一个生物(wù)药具有(yǒu)抑制作用(yòng)时,需要测量游离的生物(wù)标志(zhì)物(wù)蛋白浓度,但开发测定游离的生物(wù)标志(zhì)物(wù)蛋白的方法有(yǒu)相当的挑战性,可(kě)能(néng)需要额外的分(fēn)离步骤。
人源化的或全人源的单克隆抗體(tǐ)或重组蛋白,作為(wèi)药物(wù)给予受试者/动物(wù)后,可(kě)诱导形成针对该生物(wù)药的抗體(tǐ),特别是在临床前的动物(wù)试验中,这些由生物(wù)药诱导而形成的抗體(tǐ)通常被称為(wèi)抗药物(wù)抗體(tǐ)(ADA)。免疫检测方法是检测ADA是否存在于血清中的第一级检测。不同的ADA反应,如表位特异性(idiotype vs. nonidiotype,特异与非特异性)和数量(滴度或相对浓度),会影响对ADA和生物(wù)药的准确定量。由于ADAs会在血液循环中与生物(wù)药形成免疫复合物(wù),高浓度的蛋白生物(wù)药能(néng)够干扰ADA的检测。
备注:idiotype:免疫球蛋白(如IgG)可(kě)变區(qū)域的分(fēn)子结构和构象,赋予其抗原特异性。
LBA测试方法在各种生物(wù)分(fēn)子的定量分(fēn)析方面拥有(yǒu)各种优势。它们在大多(duō)数平台(如比色计或平面電(diàn)化學(xué)发光)上,成本通常很(hěn)低。当高亲和力MAbs用(yòng)于LBAs时,LBA方法在检测和定量分(fēn)析存在于异质性的基质环境中的目标分(fēn)析物(wù)方面,具有(yǒu)高度灵敏度和特异性。出于研究目的,该类方法的灵敏度可(kě)以低至每毫升毫微微克的级别(femtogram/mL)。大多(duō)数LBAs的操作程序不涉及样品分(fēn)离的步骤,而基于LC-MS/MS的定量分(fēn)析方法则需要。当然,LBA也有(yǒu)几个缺点,与LC-MS/MS方法相比,LBA方法的动态范围较狭窄。虽然用(yòng)于基础研究的方法可(kě)以达到4-6个指数级的动态范围,但用(yòng)于规范性研究(regulated study)的验证过的方法,其定量范围往往仅為(wèi)2-3个指数级,这是因為(wèi)必须保持方法的稳健性和更好的重现性。
最重要的區(qū)别是,LBA的性能(néng)取决于所使用(yòng)试剂的质量和特异性。因此,试剂生成/选择(MAbs或PAbs)是方法开发过程中的关键步骤,这可(kě)能(néng)非常耗时,3到9个月不等。当使用(yòng)分(fēn)析物(wù)特异性的试剂来捕获目标分(fēn)析物(wù)时,这个缺点对LC-MS/MS方法也是存在的。从生物(wù)标志(zhì)物(wù)方法的角度来看,试剂的交叉反应可(kě)导致该方法的非特异性。因此,强烈建议进行额外的测试以阐明试剂的交叉反应性和非特异性。
本文(wén)概述了LBA测试方法,包括其主要概念的起源和演变,并且回顾了常用(yòng)的大分(fēn)子生物(wù)分(fēn)析方法的测试格式。最初的LBA测试方法诞生于1960年,是為(wèi)测定胰岛素而开发的放射免疫测试(radioimmunoassay),LBA测试方法的基础是至少有(yǒu)一种蛋白质与感兴趣的目标分(fēn)析物(wù)有(yǒu)相互作用(yòng)。在当今的实验室, 酶免疫测试(enzyme immunoassay)已在很(hěn)大程度上取代了放射性免疫测试,成為(wèi)了LBA测试方法的首选形式。
此外,本文(wén)还介绍了其它各种测试格式,如竞争式(competitive)、夹心式(sandwich)和桥接式(bridging),以及其所需的关键试剂。最后,简明扼要地讨论了LBA测试方法在蛋白质生物(wù)药开发中的应用(yòng),以及与其它生物(wù)分(fēn)析平台的比较。
自上世纪60年代对胰岛素进行定量测定以来,基于与其它生物(wù)分(fēn)子结合作用(yòng)的LBA方法已被广泛地用(yòng)于生物(wù)分(fēn)子的定量分(fēn)析。例如,在蛋白质生物(wù)药开发过程中,这些方法為(wèi)定量分(fēn)析或检测蛋白质提供了一种准确和经济有(yǒu)效的方法。测试试剂(MAbs或PAbs)生成/选择是LBA方法开发过程中的关键步骤,一旦选择好了试剂,不同测试平台上的LBA方法能(néng)够提供显著节约时间和经济成本。
如前所述,另一个主要的大分(fēn)子生物(wù)分(fēn)析平台是液相色谱-质谱(LC-MS/MS)。在小(xiǎo)分(fēn)子药物(wù)的生物(wù)分(fēn)析中,LC-MS/MS方法是毋庸置疑的王者,在大分(fēn)子分(fēn)析中,LC-MS/MS的重要性也在不断地增加,特别是在与LBA方法以某种形式组合之后。可(kě)以肯定,生物(wù)分(fēn)析业界将继续探索LC-MS/MS在蛋白质药物(wù)的生物(wù)分(fēn)析中的应用(yòng)。生物(wù)分(fēn)析行业必须证明LC-MS/MS在药物(wù)开发的整个过程中,与LBA方法相比较,具有(yǒu)重现性(reproducibility)、可(kě)转移性(transferability)、可(kě)靠性(reliability)和成本效益(cost–effectiveness)等方面的显著优势。本系列后续将介绍相关知识,敬请关注。
本文(wén)来源:生物(wù)制药小(xiǎo)编
本文(wén)如有(yǒu)疏漏和误读相关指南和数据的地方,请读者评论和指正。所有(yǒu)引用(yòng)的原始信息和资料均来自已经发表學(xué)术期刊、官方网络报道等公开渠道, 不涉及任何保密信息。参考文(wén)献的选择考虑到多(duō)样化但也不可(kě)能(néng)完备。欢迎读者提供有(yǒu)价值的文(wén)献及其评估。
1. Thway TM. Fundamentals of large-molecule protein therapeutic bioanalysis using ligand-binding assays. Bioanalysis (2016) 8(1), 11–17
2. Yalow RS, Berson S A. Immunoassay of endogenous plasma insulin in man. J. Clin. Inv. 39, 1157–1175 (1960).
3. Moss AJ, Dalrymple GV, Boyd CM. Practical Radioimmunoassay. The C.V Mosby, St. Louis, MO, USA (1976).
4. Jaffe BM, Behrman H. Methods of Hormone Radioimmunoassay. Academic, New York, NY, USA, (1979).
5. Travis JC. Fundamentals of RIA and Other Ligand Assays. Scientific Newsletters, Anaheim, CA, USA (1979).
6. Engvall E. Enzyme immunoassay ELISA and EMIT. In: Methods in Enzymology Volume 70. van Vunakis H, Langone J (Eds). Academic, New York, NY, USA, 419–439 (1970).
7. Engvall E, Perlmann P. Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G. Immunochemistry 8, 871–874 (1971).
8. Jenkins R, et al. “Recommendations for Validation of LC-MS/MS Bioanalytical Methods for Protein Biotherapeutics.” The AAPS Journal1 (2015): 1–16. PMC. Web. 13 Apr. 2016
9. Gao XL, et al. Quantitative analysis of factor P (Properdin) in monkey serum using immunoaffinity capturing in combination with LC–MS/MS. Bioanalysis, March 2016,Vol. 8, No. 5, Pages 425-438 , DOI 10.4155/bio.15.258
10. Zhang YJ, et al. The integration of ligand binding and LC-MS-based assays into bioanalytical strategies for protein analysis. Bioanalysis July 2014 ,Vol. 6, No. 13, Pages 1827-1841 , DOI 10.4155/bio.14.128 (doi:10.4155/bio.14.128)
11. Van Dyke K. Biolumisencence and chemiluminescence: instruments and applications, vol I/II. CRC Press, Baton Roca, FL, USA (1985).
12. Schaap AP, et al. Chemiluminescent substrates for alkaline phosphatase: application to ultrasensitive enzyme-linked immunoassays and DNA probes. Clin. Chem. 35(9), 1863–1864 (1989)
13. Stanley PE, Kricka LJ. Bioluminescence and Chemiluminescence, Current Status. Wiley, New York, NY, USA (1991).
14. Lipman NS, et al. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR J. 46(3), 258–68 (2005).
15. DeSilva B, et al. Recommendations for the bioanaltyical method validation of ligand-binding assays to support pharmacokinetic assessments of macromolecules. Pharm. Res. 11, 1885–1900 (2003).
16. Lee J, Ma H. Specificity and selectivity evaluations of ligand binding assay of protein therapeutics against concomitant drugs and related endogenous proteins. AAPS J. 9(2), e164–e170 (2007).
17. Lee JW, et al. Bioanalytical approaches to quantify “total” and “free” therapeutic antibodies and their targets: technical challenges and PK/PD applications over the course of drug development. AAPS J. 13(1), 99–110 (2011).
18. Shih JY, et al. Implementation of a universal analytical method in early-stage development of human antibody therapeutics: application to pharmacokinetic assessment for candidate selection. Bioanalysis 4, 2357–2365 (2012).
19. Lee JW. Method validation and application of protein biomarkers: basic similarities and differences from biotherapeutic. Bioanalysis 1, 1461–1473 (2009).
20. Shankar G, et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. JPBA 15(48), 1267–1281 (2008).
21. Thway TM, et al. Impact of antidrug antibodies in preclinical pharmacokinetic assessment. J. Pharm. Biomed. Anal. 15(3), 856–862. (2013).
22. Cai XY, et al. Challenges of developing and validating immunogenicity assays to support comparability studies for biosimilar drug development. Bioanalysis 4(17), 2169–2177 (2012).

