

























今日(12月20日),國(guó)家卫健委办公厅发布了《新(xīn)型抗肿瘤药物(wù)临床应用(yòng)指导原则(2019年版)》(下称《原则》),该《原则》由“新(xīn)型抗肿瘤药物(wù)临床应用(yòng)指导原则”和“各系统肿瘤的药物(wù)临床应用(yòng)指导原则”两部分(fēn)组成,其中“各系统肿瘤的药物(wù)临床应用(yòng)指导原则”共涉及8类临床药物(wù)。

新(xīn)型抗肿瘤药物(wù)临床应用(yòng)指导原则
(2019年版)



现代抗肿瘤药物(wù)的一个显著特征,是出现一批针对分(fēn)子异常特征的药物(wù)——即靶向药物(wù)。最具代表性的药物(wù)是针对表皮生長(cháng)因子信号通路异常的酪氨酸激酶抑制剂。目前,根据是否需要做靶点检测,可(kě)以将常用(yòng)的小(xiǎo)分(fēn)子靶向药物(wù)和大分(fēn)子单克隆抗體(tǐ)类药物(wù)分(fēn)為(wèi)两大类(表1)。具體(tǐ)的检测靶点详见各章节。
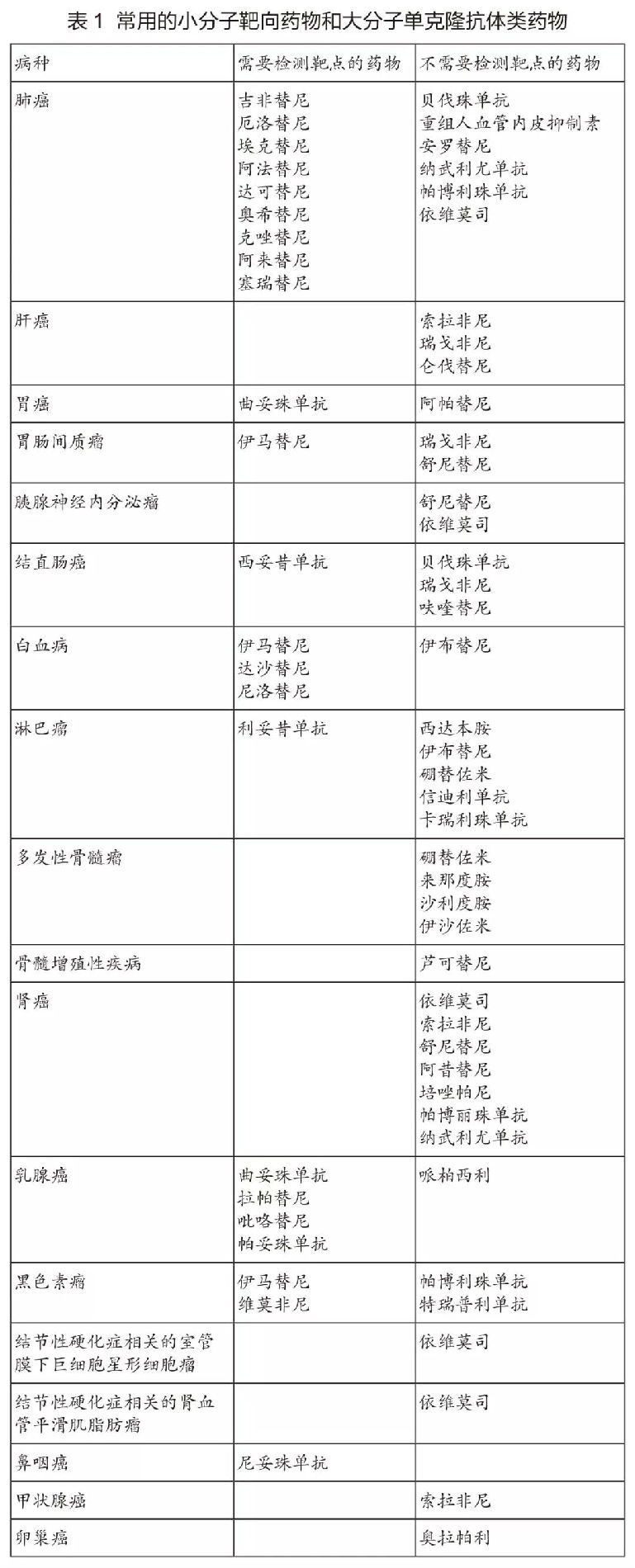
对于有(yǒu)明确靶点的药物(wù),须遵循靶点检测后方可(kě)使用(yòng)的原则。检测所用(yòng)的仪器设备、诊断试剂和检测方法应当经过國(guó)家药品监督管理(lǐ)部门批准,特别是经过伴随诊断验证的方法。不得在未做相关检查的情况下盲目用(yòng)药。

