

























乙肝是由一种包膜DNA病毒-乙肝病毒(HBV)感染肝脏引起的肝细胞坏死和炎症,乙肝表面抗原持续阳性6个月或以上则定义為(wèi)慢性乙肝(CHB)。慢性乙肝的主要并发症為(wèi)肝硬化和肝细胞癌,大约20%到30%的慢性感染者会出现这些并发症。
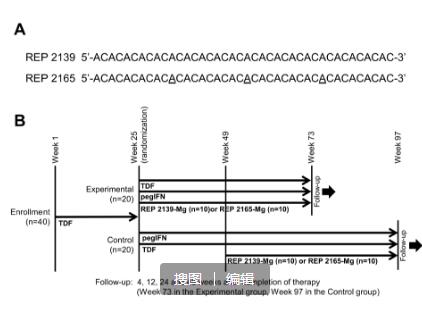
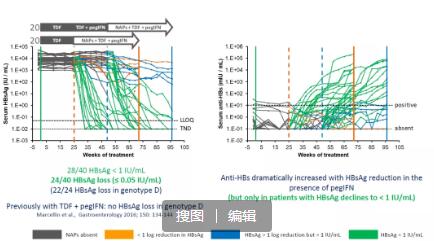
博济医药结合自身在肝脏疾病研发领域拥有(yǒu)的丰富项目经验和专家资源,将NASH和乙肝新(xīn)药临床研究列為(wèi)公司重大项目和重点发展业務(wù)。博济医药已成立特色的肝病临床研究团队,由肝病专业特長(cháng)的专家和骨干组成,旨在打造一支肝病领域的标杆团队,高质高效服務(wù)客户。

