

























随着审评审批制度改革和鼓励创新(xīn)的持推进以及《真实世界证据支持药物(wù)研发与审评的指导原则(试行)》《真实世界证据支持儿童药物(wù)研发与审评的技术指导原则(征求意见稿)》的相继出台,真实世界研究成為(wèi)业界关注的焦点。
鉴于业界对真实世界研究的概念、设计原则、实施步骤和方法、数据分(fēn)析与解读等尚缺乏清晰的认知。日前,经中國(guó)医药质量管理(lǐ)协会批准,由临床研究质量与评价专业委员会主办,博济医药承办的真实世界研究系列直播讲座重磅启动,该直播讲座旨在围绕真实世界数据和真实世界证据进行全面解读。
系列直播首场便邀请到了北京协和医學(xué)院基础學(xué)院研究员单广良為(wèi)广大网友解读真实世界数据与证据、真实世界研究类型、分(fēn)享真实世界研究设计实施、数据处理(lǐ)、统计方法以及真实世界数据的理(lǐ)性分(fēn)析和解读。
以下是单广良教授直播内容整理(lǐ)。
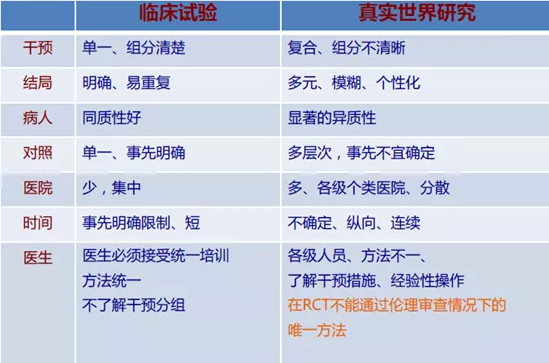
真实世界(Real World)最早见于1993年Kaplan发表的关于雷米普利上市后评价研究。真实世界研究(Real World Study,RWS),就是起源于药物(wù)上市后评价的实用(yòng)性临床研究。开始时是药物(wù)在临床实践中应用(yòng)的进一步评价,对患者不加过多(duō)的筛选条件限制,干预措施接近临床实际场景,旨在评价药物(wù)在实际应用(yòng)条件下的有(yǒu)效性、安全性和效果。
经过多(duō)年的发展和实践,对真实世界研究的定义逐步达成共识,有(yǒu)组织有(yǒu)计划地使用(yòng)观察性研究方法,收集统一的临床及相关数据,对某一特定疾病的人群,或暴露在某一特定因素下的人群进行特定结局的评价,从而达到制定和完善临床决策和医保政策目的的一种研究方法。
我國(guó)现有(yǒu)典型的真实世界数据包括:
區(qū)域医疗健康数据库
医院電(diàn)子病历数据
医保数据
公共卫生调查与公共健康监测
出生/死亡登记数据
患者登记数据
了解疾病的临床特征和治疗效果全貌
评估临床医生遵循指南的现状和更新(xīn)需求
评估不同医疗中心的医疗质量
评估治疗措施综合效益
國(guó)家医药和医保在政策制定的依据
上市药品和医疗器械有(yǒu)效性和安全性的再评价
國(guó)际多(duō)中心注册研究可(kě)使医生和管理(lǐ)者对國(guó)家间疾病特征和医疗质量进行比较
O: Outcomes |
S: Study design |
T: Time span |
E: Electronic medical record system |
R: Result analysis and interpretation |

