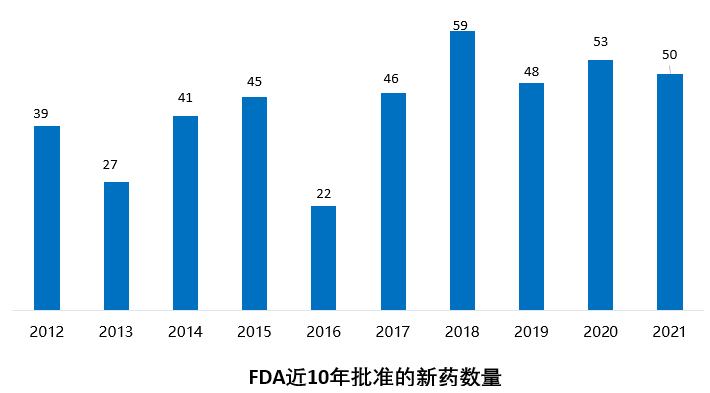
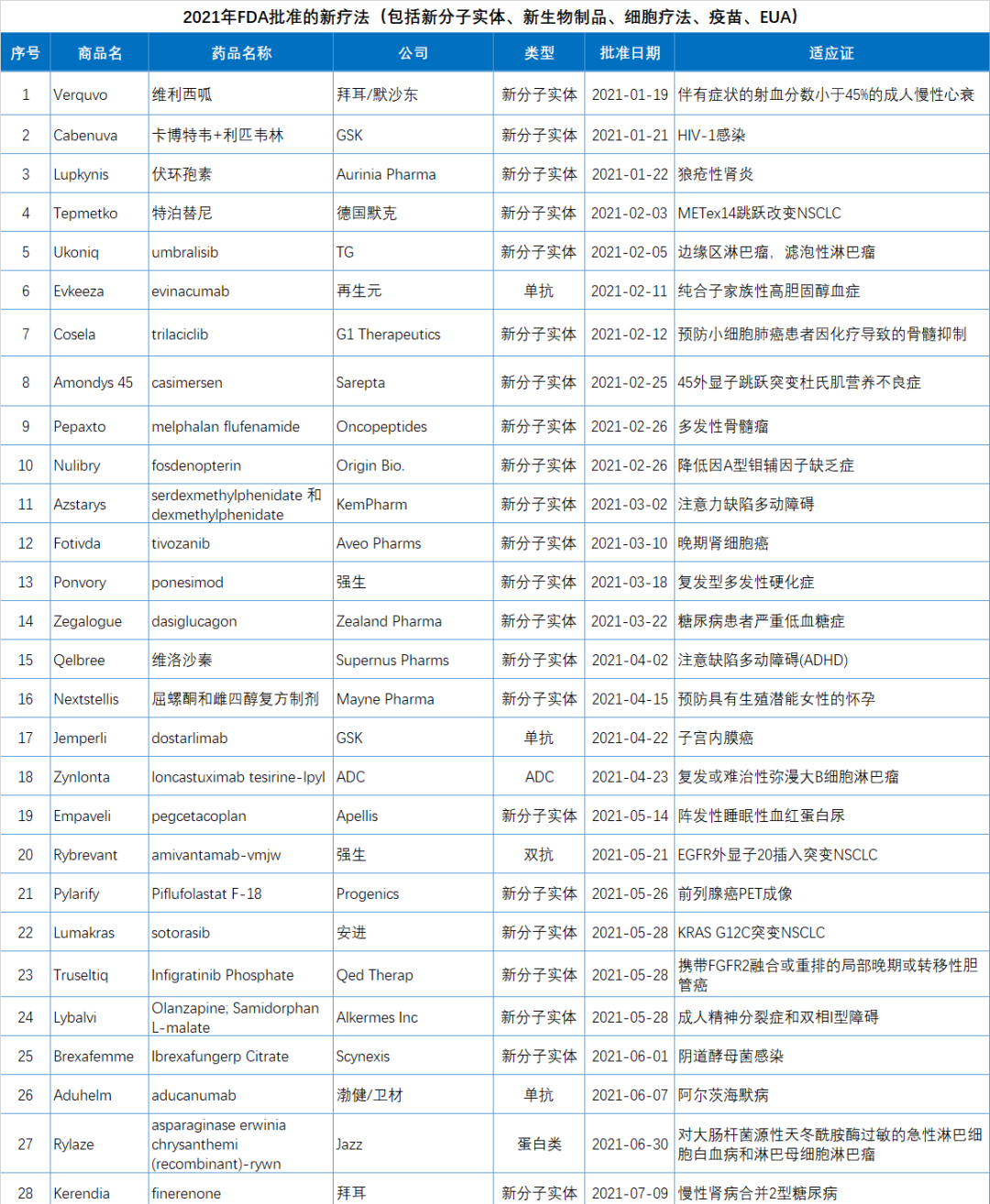
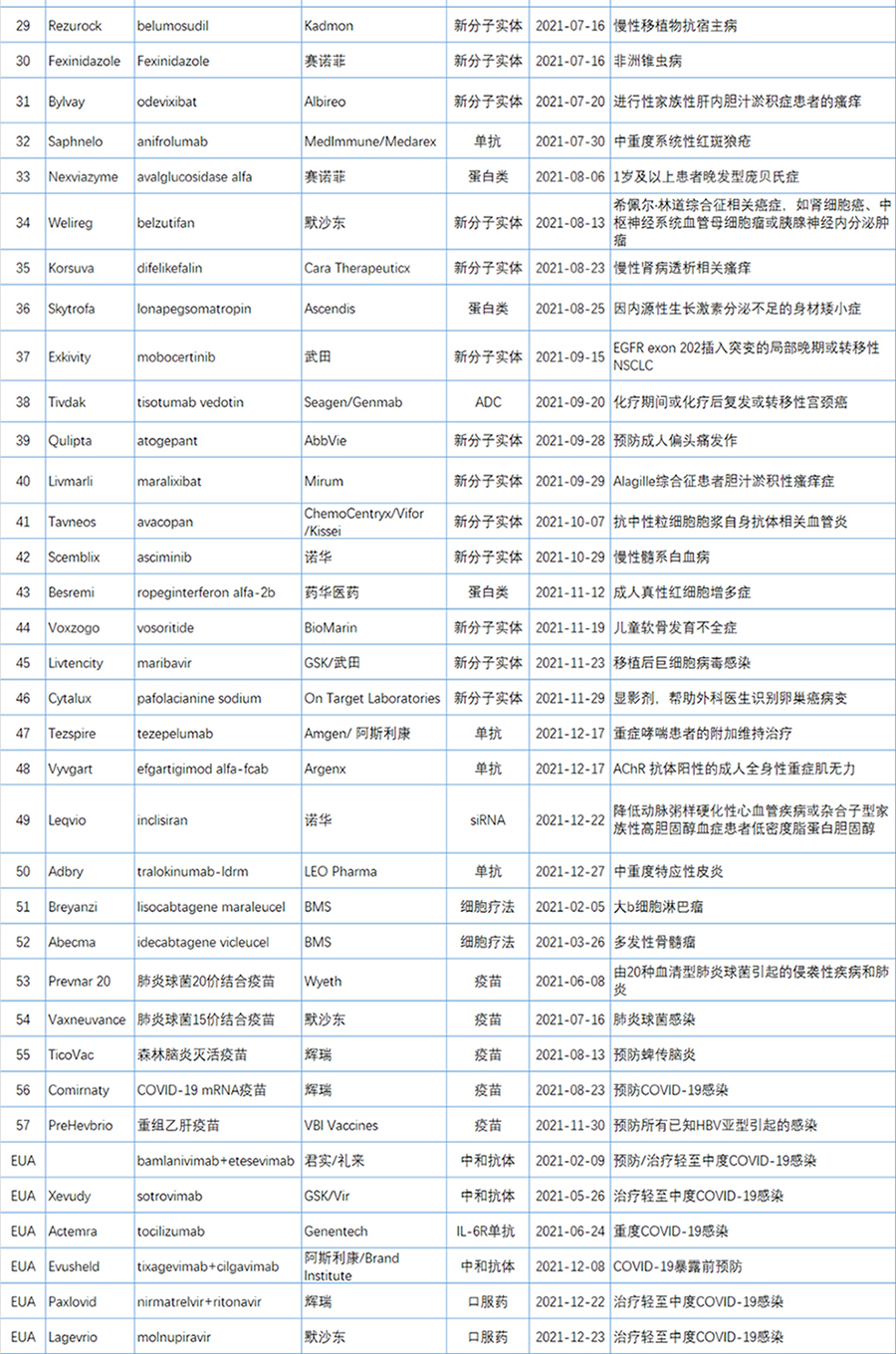
2021年FDA共批准50款新(xīn)药(不包括细胞疗法和疫苗),较2020年的53款新(xīn)药审批略有(yǒu)下降。
相比FDA的略有(yǒu)下降,中國(guó)的新(xīn)药审批则迎来的井喷。数据显示,2021年國(guó)家药品监督管理(lǐ)局共批准83款新(xīn)药,其中國(guó)产新(xīn)药51款,进口新(xīn)药32款,创下了自2016年药品审评审批改革以来的新(xīn)高。
2021年FDA共批准50款新(xīn)药(不包括细胞疗法和疫苗),包括36个新(xīn)分(fēn)子实體(tǐ)和14个新(xīn)生物(wù)制品。
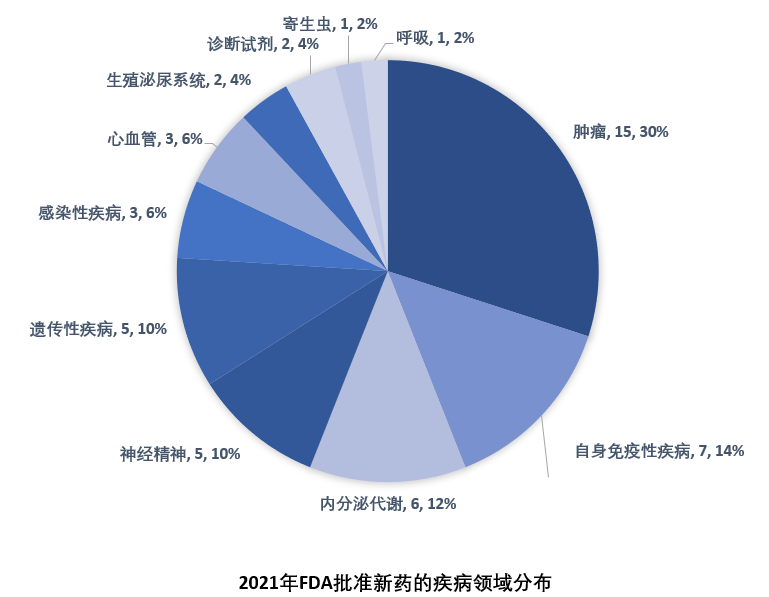
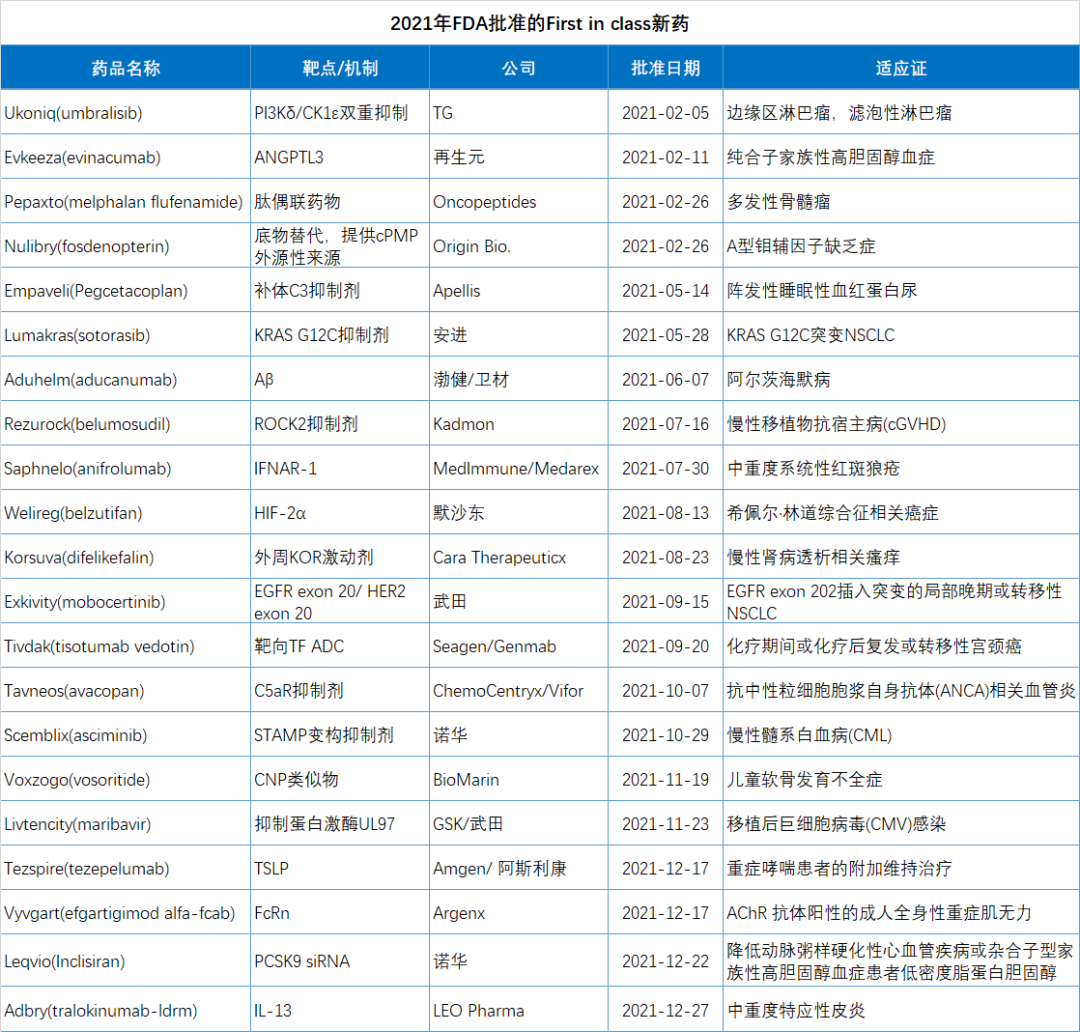
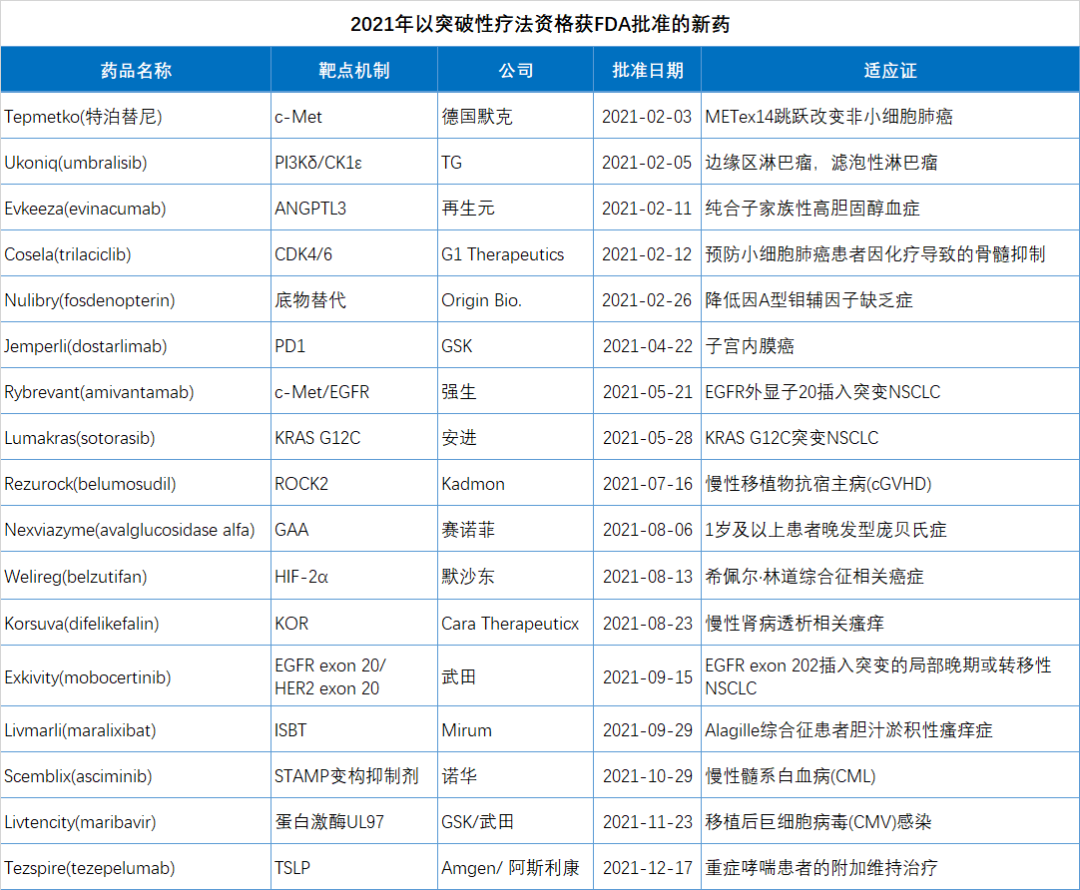
由于篇幅所限,本文(wén)精选了2021年批准的15个突破性疗法进行简单介绍。
Tepmetko由德國(guó)默克自主研发,可(kě)抑制MET基因突变引起的致癌MET受體(tǐ)信号。该产品最早于2020年3月在日本获批上市,是全球首个获得监管部门批准用(yòng)于治疗MET基因突变晚期NSCLC的口服MET抑制剂,同时也是FDA批准的首个也是唯一一个每日口服1次的MET抑制剂。
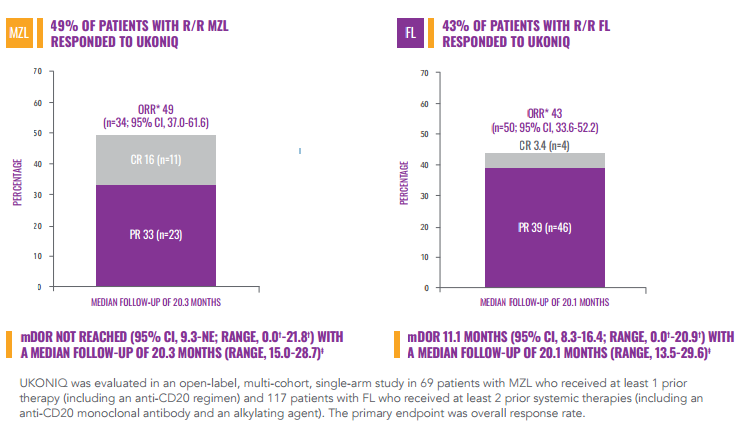
Umbralisib由TG公司开发,是首个也是唯一一个获批上市的每日口服1次的磷酸肌醇3激酶(PI3K ) δ和酪蛋白激酶1 (CK1) ε抑制剂。
MZL和FL适应症的加速获批是基于一项开放标签,多(duō)中心,双队列II期UNITY-NHL研究总缓解率(ORR)数据。研究结果表明,MZL患者的总缓解率(ORR)為(wèi)49% ,完全缓解率(CR)為(wèi)16%,中位缓解持续时间(DOR)尚未达到。FL患者ORR為(wèi)43%,CR為(wèi)3.4%,DOR為(wèi)11.1个月。
Evkeeza由再生元开发,是FDA批准的首个靶向血管生成素样蛋白3(ANGPTL3)的药物(wù)。ANGPTL3是肝脏分(fēn)泌的一种蛋白,主要在人和小(xiǎo)鼠肝脏表达,在脂质代謝(xiè)中发挥着关键作用(yòng),与脂代謝(xiè)紊乱、冠心病与动脉粥样硬化、糖尿病、代謝(xiè)综合征、肾病以及肝癌等疾病有(yǒu)关。
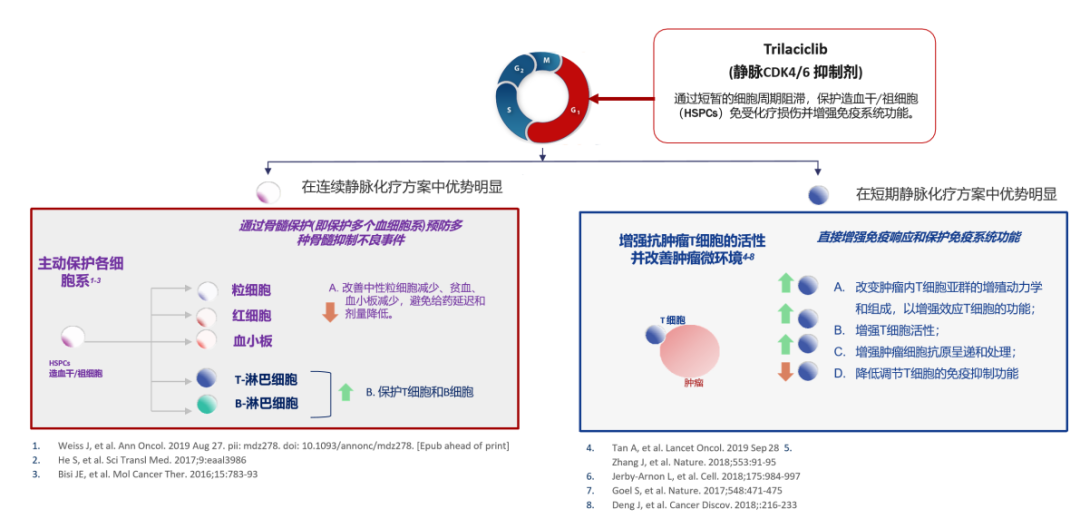
Trilaciclib由G1Therapeutics开发,是全球首个也是唯一一个化疗开始前预防性给药以保护骨髓和免疫系统功能(néng)的产品。
Trilaciclib是First-in-class的短效小(xiǎo)分(fēn)子CDK 4/6抑制剂,在化疗前预防性使用(yòng),可(kě)以将骨髓细胞短暂阻滞在细胞周期的G1期,显著减少化疗药对骨髓细胞的杀伤,保护骨髓细胞和免疫系统功能(néng)。

VHL是一种罕见的遗传性疾病,每3.6万人中就有(yǒu)1人患病,在美國(guó)估计有(yǒu)1万人患VHL。VHL患者不仅有(yǒu)罹患良性血管肿瘤的风险,也有(yǒu)罹患某些癌症的风险,包括肾细胞癌。
Welireg是FDA批准的首个HIF-2α抑制剂疗法。通过抑制HIF-2α,Welireg可(kě)降低与细胞增殖、血管生成和肿瘤生長(cháng)相关的HIF-2α靶基因的转录和表达。
Korsuva由Cara Therapeutics和Vifor Pharma联合开发,是一款first in class高选择性k阿片受體(tǐ)(KOR)完全激动剂,能(néng)够抑制产生瘙痒的外周神经元的活性,并且对其他(tā)受體(tǐ)(包括mu或delta阿片类受體(tǐ))、离子通道或转运體(tǐ)无显著活性。
另外,不同于小(xiǎo)分(fēn)子KOR激动剂,Korsuva是一款小(xiǎo)型合成肽,主要激活外周神经元(PNS)和免疫细胞表达的KORs。是FDA批准的首个也是唯一一个治疗此类患者的疗法。
Exkivity由武田开发,是一种专门设计用(yòng)于选择性靶向EGFR外显子20插入突变的强效口服小(xiǎo)分(fēn)子酪氨酸激酶抑制剂。同时也是美國(guó)FDA批准的首款专门為(wèi)携带EGFR外显子20插入突变的NSCLC患者设计的口服疗法。
Livmarli是一种每日口服1次的回肠胆汁酸转运體(tǐ)(IBAT)抑制剂,可(kě)通过抑制IBAT的再摄取改变胆汁酸的流向,阻断胆汁酸在肝脏的再循环,增加粪便胆汁酸排泄来防止胆汁酸在肝脏的积聚。Livmarli是FDA批准的首个也是唯一一个治疗这种罕见肝病的药物(wù)。
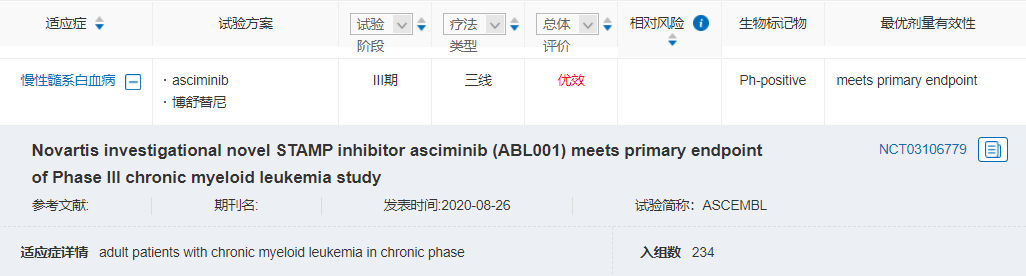
Asciminib是一种专门针对ABL肉豆蔻酰口袋 (STAMP) 的药物(wù)。作為(wèi)STAMP 抑制剂,asciminib与BCR-ABL1结合的位点与常见TKI不同,可(kě)能(néng)有(yǒu)助于解决CML后線(xiàn)治疗中TKI耐药和不耐受问题。
FDA此项批准是基于III期ASCEMBL试验和I期试验(NCT02081378)结果。ASCEMBL试验结果显示,治疗24周,asciminib vs 博舒替尼的MMR比率為(wèi)25% vs 13%。因不良事件导致的停药率為(wèi)7% vs 25%。
Tezspire由阿斯利康和安进联合开发,是一款first in class生物(wù)制剂,通过阻断TSLP阻止免疫细胞释放促炎细胞因子,从而预防哮喘发作和改善哮喘控制。

目前治疗哮喘的生物(wù)制品只针对T2炎症,tezepelumab则具有(yǒu)不同的作用(yòng)机制,能(néng)够阻断多(duō)条炎症信号通路上游的TSLP,在级联的顶端起作用(yòng),从源头上抑制炎症,从而治疗广泛的严重哮喘患者群體(tǐ)。
在國(guó)内,tezepelumab已处于III期临床阶段。开发TSLP靶向药的企业包括康诺亚、和铂医药、恒瑞医药。
附表:
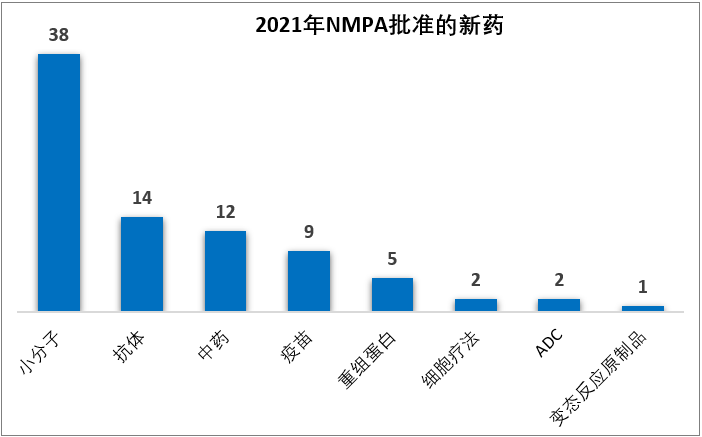
2021年批准的新(xīn)药数量创下了自2016年药品审评审批改革以来的新(xīn)高,尤其是中药新(xīn)药在沉寂数年之后迎来了大爆发,2021年批准了12款中药,相比之下,NMPA之前2016-2020这5年累计批准的中药新(xīn)药是14款。
从疾病领域来看,2021年NMPA批准的新(xīn)药仍以肿瘤药居多(duō),占比31%(26/83);其他(tā)占比较高的疾病领域还包括感染性疾病(28%,23/83)、内分(fēn)泌代謝(xiè)(12%,10/83)、神经精神(11%,9/83)、血液6%(5/83)。
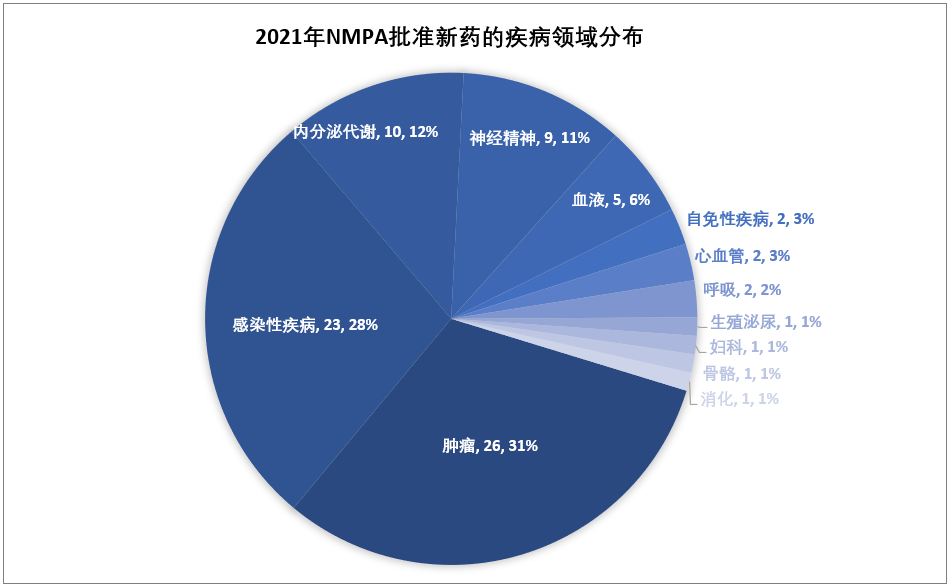
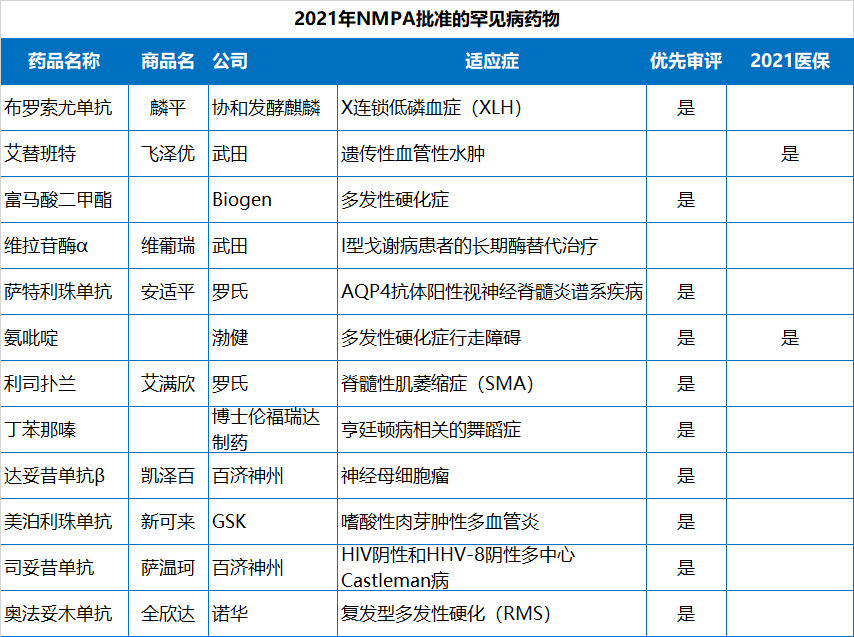
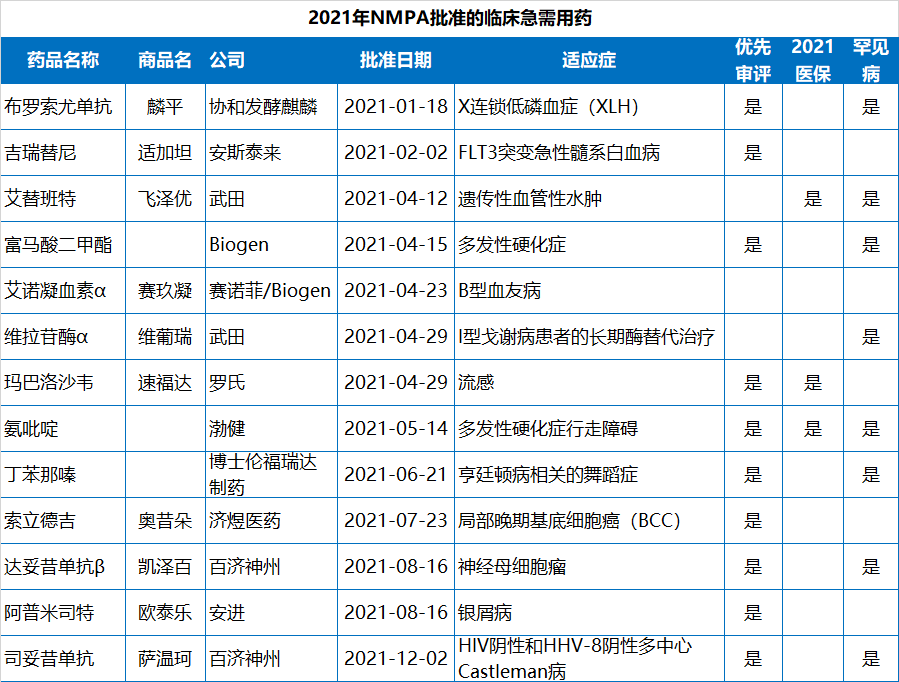
2021年NMPA批准的83个新(xīn)药中,有(yǒu)49个是以“优先审评”的方式获批,占比59%,化药、生物(wù)药、中药均有(yǒu)涉及;此外,NMPA在2021年批准了12个罕见病药物(wù)(均為(wèi)进口药),13个临床急需用(yòng)药。
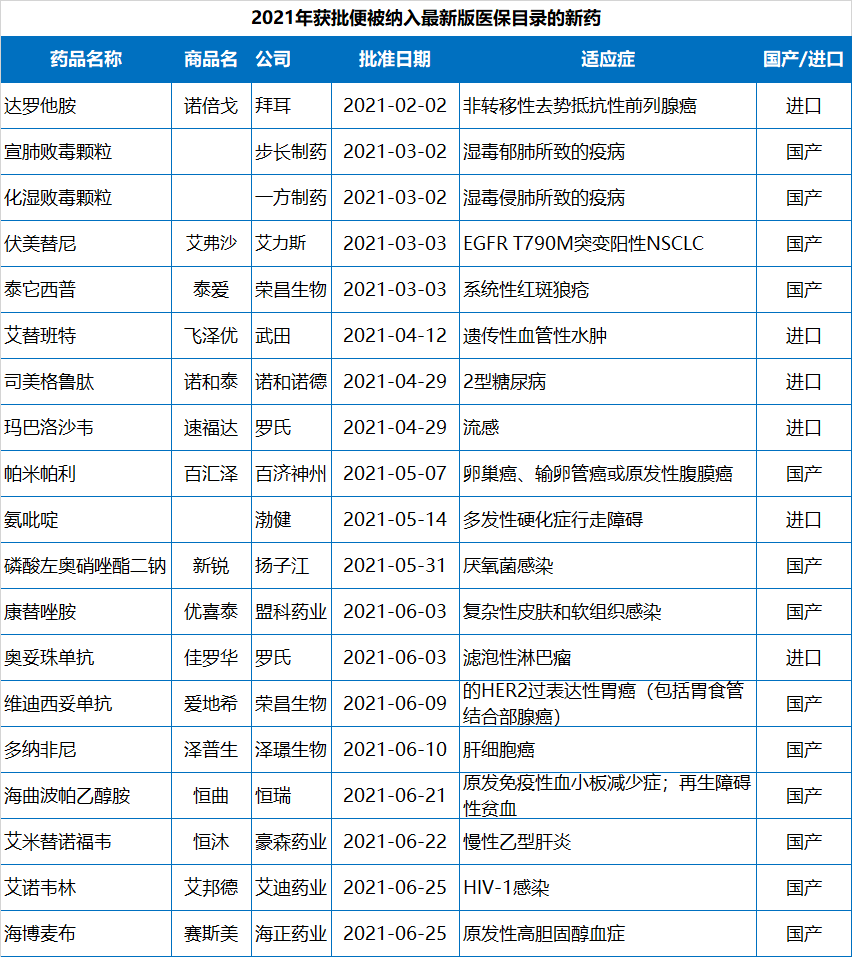
值得指出的是,2021年NMPA批准的83款新(xīn)药中,已经有(yǒu)19款通过医保谈判纳入了2021年國(guó)家医保目录,包括13款國(guó)产新(xīn)药和6款进口新(xīn)药。协议有(yǒu)效期為(wèi)2022年1月1日—2023年12月31日。
2021年NMPA批准的83个新(xīn)药中,有(yǒu)10款曾被CDE纳入突破性疗法,有(yǒu)10款属于First in class新(xīn)药。有(yǒu)17款新(xīn)药是附条件批准上市。
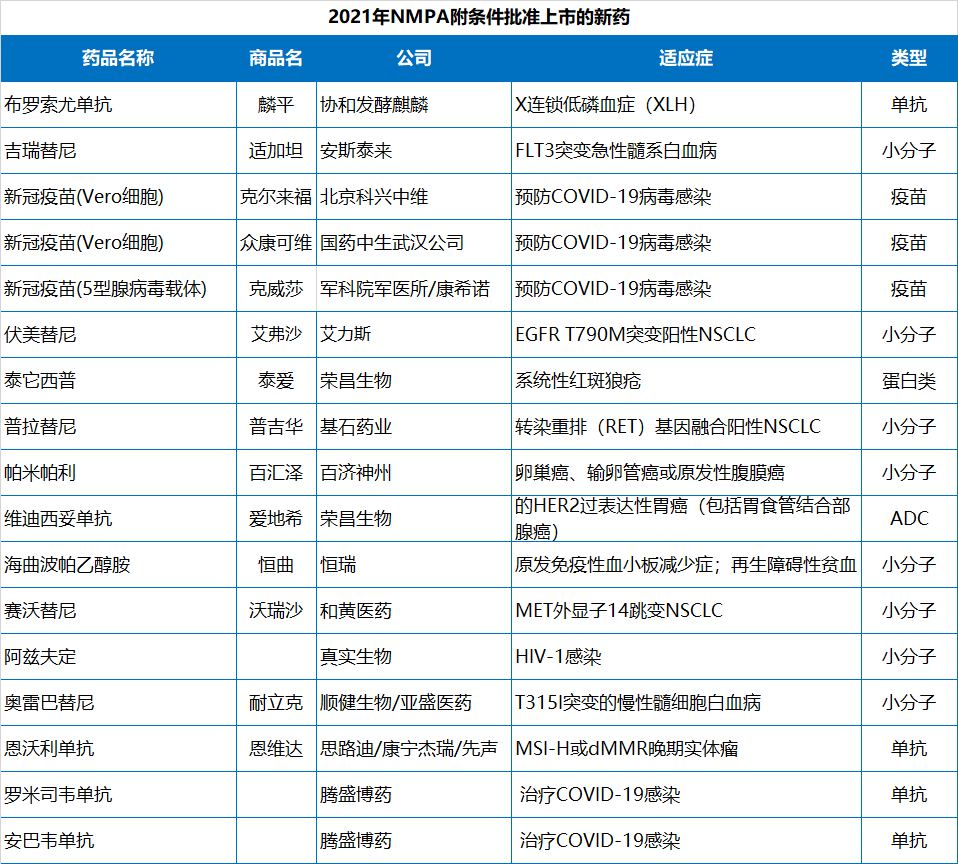
以PD-1/PD-L1為(wèi)代表的免疫检查点抑制剂的上市显著改善了癌症患者的生存结局和生活质量。然而,PD-1/PD-L1药物(wù)的巨大商(shāng)业前景也引发了me too药物(wù)的扎堆研发,造成同质化竞争严重。
今年,NMPA共批准了4款PD-1/PD-L1,且全都由本土企业开发。分(fēn)别来自正大天晴/康方生物(wù)、誉衡生物(wù)、思路迪/康宁杰瑞/先声药业、基石药业。截止目前,國(guó)内已有(yǒu)12款PD-1/PD-L1药物(wù)上市。
2021年NMPA批准的PD-1/PD-L1药物(wù)
随着医药改革,國(guó)家政策和资本对创新(xīn)药开发的支持,我國(guó)多(duō)款本土创新(xīn)药迎来收获期,且多(duō)款药品都是企业的首个商(shāng)业化产品。
艾力斯医药开发的三代EGFR-TKI伏美替尼、泽璟生物(wù)开发的首个國(guó)产肝癌一線(xiàn)靶向药多(duō)纳非尼、德琪医药选择性核输出蛋白(SINE)抑制剂塞利尼索、真实生物(wù)开发的首个双靶点抗HIV-1药物(wù)阿兹夫定、盟科(kē)药业历经十二年开发的新(xīn)一代噁唑烷酮类抗菌药康替唑胺、亚盛医药的三代BCR-ABL TKI奥雷巴替尼、腾盛博药/清华大學(xué)/深圳市第三人民(mín)医院联合开发的新(xīn)冠中和抗體(tǐ)鸡尾酒疗法安巴韦单抗/罗米司韦单抗、誉衡生物(wù)开发的抗PD-1抗體(tǐ)赛帕利单抗、华昊中天埃博霉素类抗癌药优替德隆等均為(wèi)这些公司首款获批新(xīn)药。
此外,还有(yǒu)部分(fēn)本土企业在今年获批了不止一款新(xīn)药,例如恒瑞,今年连批3款新(xīn)药。在2021年的最后一天迎来了公司的第9、10款新(xīn)药CDK4/6抑制剂达尔西利和SGLT-2抑制剂恒格列净,该公司今年6月份获批的新(xīn)药海曲波帕乙醇胺片也顺利被纳入最新(xīn)版(2021版)医保目录。
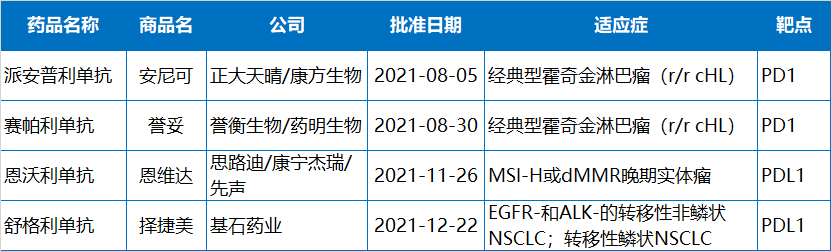
具离新(xīn)冠疫情爆发已过去两年时间,但人类仍在与新(xīn)冠病毒做着顽强斗争。在中國(guó),科(kē)學(xué)家和监管机构也在努力将新(xīn)冠治疗和预防药物(wù)递送到人民(mín)手中。今年,國(guó)家药监局附条件批准了3款新(xīn)冠疫苗和1款新(xīn)冠中和抗體(tǐ),3款疫苗分(fēn)别来自北京科(kē)兴中维、國(guó)药中生武汉公司、军科(kē)院军医所/康希诺。新(xīn)冠中和抗體(tǐ)则来自腾盛博药/清华大學(xué)/深圳市第三人民(mín)医院。
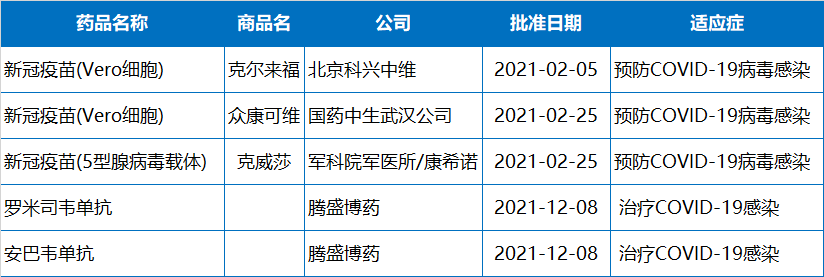
6月9日,國(guó)家药品监督管理(lǐ)局(NMPA)附条件批准荣昌生物(wù)自研注射用(yòng)维迪西妥单抗(Disitamab Vedotin,商(shāng)品名:爱地希®)上市,适用(yòng)于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。这意味着中國(guó)迎来了首个國(guó)产ADC药物(wù),维迪西妥单抗成為(wèi)荣昌生物(wù)继系统性红斑狼疮新(xīn)药泰它西普之后第2个进入商(shāng)业化阶段的新(xīn)药。